精選版 日本国語大辞典 「薬物療法」の意味・読み・例文・類語
やくぶつ‐りょうほう ‥レウハフ【薬物療法】
出典 精選版 日本国語大辞典精選版 日本国語大辞典について 情報
内科学 第10版 「薬物療法」の解説
薬物療法(治療学総論)
適正な薬物治療のためには,医薬品それぞれの特性をよく理解して臨床の場で活用する必要がある.それが臨床薬学である.特に薬剤師は医薬品に関する専門家として,またチーム医療の一員として臨床の場で積極的にその役割を果たすことが期待されており,診療報酬上においてもその血中薬物濃度測定に基づき投与計画や評価を行う特定薬剤治療管理料や薬剤管理指導料などが設定されている.この臨床薬学を支えるのが治療薬物モニタリング(therapeutic drug monitoring:TDM)をはじめとした薬物動態学,薬力学,ゲノム薬理学,医薬品情報学などである.
a.臨床薬学の基盤となる薬物動態学・薬力学・ゲノム薬理学・医薬品情報学
薬物動態学はファーマコキネティクス(pharmacokinetics:PK)といわれ,薬物が投与されてから効果が発現するまでの過程では,薬物の吸収・分布・代謝・排泄といった体内動態を扱い,薬物の投与量や投与速度に応じて薬物血中濃度の時間推移を予測することができる.一方,薬力学はファーマコダイナミクス(pharmacodynamics:PD)といわれ,作用部位における薬物濃度と効果の関係を扱い,薬物濃度に応じた作用強度を予測することができる.薬物はその血中濃度が有効治療濃度域に達しないと効果が期待できない.しかし有効治療濃度域をこえてしまうと中毒域に達してしまい副作用が発生することになる(図3-1-13).特に有効治療濃度域が狭く治療域と中毒域が近い場合や,薬物体内動態の個人間の変動が大きい場合にはTDMを実施して有効かつ安全に薬物治療を実施する必要がある.TDMが有効である薬物を表3-1-7に示す.
そしてゲノム薬理学すなわちファーマコゲノミクス(pharmacogenomics:PGx)は,狭義には薬理遺伝学,ファーマコジェネティクス(pharmacogenetics:PGt)ともいわれ,ICH(日米EU医薬品規制調和国際会議)のE15ガイドライン(ゲノム薬理学における用語集)によればPGtは「薬物応答(drug response)と関連するDNA配列の変異に関する研究」とされ,広義のPGxは「薬物応答と関連するDNAおよびRNAの特性の変異に関する研究」とされている.
医薬品情報学すなわちドラッグインフォメーション(drug information:DI)とは,添付文書やインタビューフォームなどの情報,緊急安全性情報(イエローレター)・安全性速報(ブルーレター),さらには学術誌からの医薬品に関する有効性や安全性の情報を評価して臨床の場に活かすものである.
b.薬物の吸収・分布・代謝・排泄について
多くの薬物は経口投与の後,小腸から吸収され,肝臓を経由し全身循環血へと移行する.この消化管からの吸収における相互作用で代表的なものは,ニューキノロン薬が水酸化アルミニウムなど金属イオンと複合体を形成して吸収が低下することである.さらに小腸上皮細胞には代謝酵素としてチトクロームP450(CYP)が存在し,また異物排出ポンプの役割をする薬物トランスポーターであるP-糖蛋白質もある.一部のカルシウム拮抗薬はCYPやP-糖蛋白質を阻害するグレープフルーツジュースを併用すると血中濃度が上昇する.逆に薬物取込みトランスポーターのOATP(organic anion transporting polypeptides)をグレープフルーツなど種々のフルーツジュースが阻害することでフェキソフェナジンの血中濃度が減少する(Dresserら,2002).またリファンピシンやサプリメントのセントジョーンズワート(セイヨウオトギリソウ)はCYPやP-糖蛋白質を誘導し,ジゴキシンの血中濃度を減少させる. 分布では血漿蛋白質結合が影響し,結合型は薬理活性がなく,非結合型が薬理活性を有する.アスピリンがテノキシカムの蛋白結合を阻害することも注意を要する.
薬物の代謝はおもに肝臓で行われ,先述のCYPやエステル加水分解酵素,グルクロン酸や硫酸との抱合などさまざまな酵素がある.CYPには多くの分子種があり,中でもCYP3A4は半数以上の薬物の代謝に関与している(表3-1-8).たとえばイトラコナゾールによるCYP3A4の代謝阻害でシンバスタチンの血中濃度上昇が起こる(Neuvonenら,1998).またCYP分子種には遺伝子多型があり,poor metabolizerでは代謝酵素機能が低下している.日本人ではCYP2A6およびCYP2C19のpoor metabolizerが多く,この場合CYP2C19の基質となるオメプラゾールの血中濃度が上昇する.CYP以外ではグルクロン酸抱合酵素の1つであるUGT1A1が遺伝的に欠損していると,イリノテカンの骨髄毒性のリスクが増大する.肝障害時にはCYP1A2やCYP2C19の活性は大きく低下するため注意を要するが,CYP2C9やCYP2D6や抱合系の酵素は大きな低下を示さない.
排泄では腎臓から尿中へ排泄される薬物が多い.したがって腎機能が低下している場合には注意を要する.特に腎機能低下時にはテオフィリンの有効治療濃度域でも副作用が発現することがある.尿中排泄には糸球体濾過,尿細管分泌,再吸収の過程がある.クロロチアジアジドがリチウムの再吸収を促進してリチウムの血中濃度が上昇したり,プロベネシドによる薬物トランスポーターの阻害でメトトレキサートの腎クリアランスが低下したりする.バンコマイシンの血中濃度は腎機能(クレアチニンクリアランス)と密接であり,TDMにより投与設計が有効である.
c.年齢の影響
身体機能が未熟な新生児期は薬物の代謝も不十分で,ビリルビン抱合能は成人の1/100程度であり,CYP活性もCYP1A2でおもに代謝されるテオフィリンのクリアランスは成人の1/10~1/5である.しかしこれらも乳児期になるとほぼ成人のレベルとなる.逆に小児期では薬物代謝能が成人より増すこともあり,テオフィリンのクリアランスは体重あたりでは成人の約2倍となり,その後減少していく.
一方,加齢に伴い多くの生理機能が低下する.まず肝臓の容積減少および肝血流量が減少し,薬物代謝速度が低下する.トリアゾラムやリドカインではクリアランスが青年の1/2以下となる.また加齢により腎機能も低下することから,尿中排泄を受けるアテノロールでは血中濃度が2倍以上になることがある.薬物に対する感受性が加齢で変化することもあり,イソプロテレノールに対する反応性は加齢とともに低下し,逆にワルファリン,ACE阻害薬などでは薬理作用が増大する.
d.薬剤管理指導業務
薬剤管理指導としてはさまざまな業務がある.まず①患者ごとに薬剤服用歴(薬歴)を作成し,この薬歴に基づいて投薬にかかわる薬剤の名称,用法,用量,効能,効果,副作用および相互作用に関するおもな情報を文書(正式には薬剤情報提供文書という)などで患者に提供して説明することがあげられる.②さらに処方された薬剤について,患者や家族から服薬状況などの情報を収集し,また薬歴に記録したり必要な指導を行ったりすることがある.③手帳などに調剤日や薬剤名,用法,用量,その他必要な注意などを記載することもあり,④後発医薬品に関する情報(存在の有無や価格など)を患者に提供することなども薬剤管理指導に含まれる.特に薬歴に基づき重複投薬や相互作用を防止するために処方した医師に問い合わせを行ったりすることは重視されている.また麻薬を調剤した場合にはその服用や管理状況,副作用の有無などを確認することや,6歳未満の乳幼児にかかわる調剤に際して,必要な指導を直接患者や家族に行い,手帳に記載することも診療報酬上,評価対象になっている. 診療報酬に直接繋がることではないが,薬の専門家である薬剤師が,医師や看護師など医療スタッフにカンファランスやクリティカルパス作成時に薬に関する助言をすることもチーム医療として必要なことである.特に入院患者においては,持参薬として患者が入院前から服用している薬剤を持ってくることがあり,この持参薬を確認することは,DPCなどの包括医療費による薬剤の有効利用ということよりも,むしろ医療安全面の観点から重要である.
(2)抗菌薬(antibacterial drug)
a.抗菌薬による薬物療法の原則
ⅰ)抗菌薬療法の目的
抗菌薬は感染症の治療に用いる薬剤である.感染症の発症には宿主と寄生体(ヒト)関係が不可欠である.さらに宿主寄生体関係が必ず感染症を発症するとは限らず,宿主感染防御能と原因微生物の病原性とその菌量によって決まってくる.抗菌薬療法は薬物によって原因微生物の菌量を減少または消失させ宿主に有利な条件をつくり,疾病を治癒させることを目的としている.
ⅱ)抗菌薬の適正使用の目的
抗菌薬は感染症の原因微生物の発育を抑制または殺滅する薬剤であるが,臨床の場で不適切な診断により,不必要な抗菌薬が使用されればさまざまな問題を生じる.そのため抗菌薬の適正使用を考慮する必要がある.抗菌薬の適正使用には第一に治療対象となる患者の感染症に最も有効かつ安全な薬剤を選択する(個人防衛の目的).第二に薬剤耐性菌の蔓延を防ぐため,抗菌薬の選択圧を最小限とする(集団防衛の目的).第三に医療資源の浪費を最小限とする(社会防衛の目的).以上の3点を常に考慮し,抗菌薬の適正使用に努めることが必要となる.
ⅲ)抗菌薬選択のプロセス
実際に抗菌薬を選択する際には適切なプロセスを考慮する.まず目前の患者の臨床症状や検査結果あるいは画像診断などから感染症の存在とその感染病巣を判断する.次に原因病原体の検索のための検査を行うが,結果はその場で得られないため,その感染症の病原体を推定し,最も抗菌力がすぐれた薬剤を選択する.さらに抗菌薬の用法と用量を判断するため,その感染病巣への薬剤の移行性がすぐれた抗菌薬を選択し,患者の重症度を判断した後,点滴静注か経口投与かを決定し,より重症例では静菌的な薬剤よりも殺菌的な薬剤を選択する.また,選択した抗菌薬の薬物動態学(pharmacokinetics:PK)/薬力学(pharmacodynamics:PD)に応じて用法と用量を決定する.最後に選択された薬剤の副作用やほかの併用薬剤との相互作用などを確認し投与する.
b.抗菌薬の分類
ⅰ)抗菌薬の作用機序による分類(表3-1-9)
1)細胞壁合成阻害薬:
細胞壁は網の目様の構造を示すペプチドグリカンで構成されている.そのペプチドグリカンの合成にはペニシリン結合蛋白質(PBP)が重要な役割を果たしている.ペニシリン系薬などのβ-ラクタム系薬はPBPの作用を阻害し,抗菌力を示す.このような作用を有する抗菌薬にはペニシリン系薬,セフェム系薬およびカルバペネム系薬があり,いずれも化学構造上β-ラクタム環を有するため,β-ラクタム系抗菌薬と総称されている.また,β-ラクタム系薬ではないが,同じく細胞壁合成阻害作用を有する薬剤にホスホマイシンがある.
2)蛋白合成阻害薬:
蛋白合成阻害薬は細菌の蛋白合成を阻害し,細菌の発育を抑制する.蛋白合成阻害薬は70S系リボソームに作用することで細菌にのみ選択毒性を示す.この作用を有する薬剤にはミノサイクリンなどのテトラサイクリン系薬,エリスロマイシンなどのマクロライド系薬,アミカシンなどのアミノグリコシド系薬,リネゾリドなどのオキサゾリジン系薬およびクロラムフェニコールなどがある.
3)核酸合成阻害薬:
DNA鎖の超らせん化を起こすDNAジャイレースに作用し,DNA複製を阻害して細菌の増殖を阻止する薬剤である.この作用を有する薬剤はレボフロキサシンなどのニューキノロン系薬がある.抗結核薬の代表的薬剤であるリファンピシンはRNAポリメラーゼに作用し,細菌の増殖を阻止する.
4)細胞膜機能阻害薬:
細胞膜機能阻害薬は細胞膜に作用して,選択的な透過性を変化させることによって細菌の生命維持に必要な細胞内成分を放出させ細菌の増殖を阻止する薬剤である.この作用を有する薬剤はコリスチン,ポリミキシンBなどのペプチド系薬である.
5)葉酸合成阻害薬:
葉酸は細菌の代謝に必須であり,多くの細菌は葉酸を自分で合成できる.葉酸合成阻害薬は細菌の周囲の環境からの葉酸の取り込みを阻害し,細菌の増殖を阻止する薬剤である.この作用を有する薬剤はサルファ薬やトリメトプリムがある.
ⅱ)抗菌薬の臓器移行性による分類(表3-1-10)
抗菌薬は点滴静注でも経口投与でも血流を介して感染病巣に達し,抗菌力を示す.さらに化学組成や親水・疎水性などの違いから臓器移行性が決定される.推定された感染病巣へ最も移行性のすぐれた抗菌薬を選択する.また,抗菌薬が無効なときはその薬剤の移行性の不良によることも考慮される.肺や気道にはマクロライド系薬やニューキノロン系薬の移行性がすぐれ,アミノグリコシド系薬の移行性は劣っている.肝臓や胆汁にはマクロライド系薬,テトラサイクリン系薬の移行性がすぐれ,ペニシリン系薬,セフェム系薬の移行性は劣っている.腎臓や尿路にはペニシリン系薬,セフェム系薬の移行性はすぐれ,マクロライド系薬の移行性は劣っている.
ⅲ)抗菌薬の細胞内移行性による分類
原因微生物のなかで結核菌,カンピロバクター,レジオネラ,クラミジアなどは細胞内寄生菌とよばれる.抗菌薬の中でペニリシン系薬,セフェム系薬,アミノグリコシド系薬などは細胞内移行性が悪いため,細胞内寄生菌の感染症には無効となる.それに対してマクロライド系薬,クロラムフェニコール,ホスホマイシンなどは細胞内移行性にすぐれた薬剤であり,細胞内寄生菌の感染症に対して有効である.
ⅳ)抗菌薬の殺菌性と静菌性による分類
試験内で微生物と抗菌薬を接触させ,抗菌薬の濃度が低くなれば,増殖が再び確認される薬剤は静菌的であり,抗菌薬が存在しなくても増殖が確認されない薬剤は殺菌的である.感染症が重症であり,より早期の治癒が必要な場合や,基礎疾患のために感染防御能が破綻している場合にはより殺菌的な薬剤が選択される.殺菌性の抗菌薬としてはペニシリン系薬,セフェム系薬,アミノグリコシド系薬,ニューキノロン系薬,モノバクタム系薬,カルバペネム系薬などがあり,静菌性の抗菌薬としてはテトラサイクリン系薬,マクロライド系薬,クロラムフェニコール,リンコマイシンなどがある.
ⅴ)薬物動態/薬力学による分類
抗菌薬は経口投与または点滴静注で投与され血流によって感染巣に到達し,その抗菌活性を示す.そのため,抗菌薬の臨床効果はその薬剤の血中濃度動態いわゆるPK(pharmacokinetics)に大きく依存することとなる.PKでは血中濃度のある種のパラメータと臨床効果の相関がそれぞれの抗菌薬によって規定されている.抗菌薬のPKパラメータは同じ用量で投与された患者から採血された血中濃度のポピュレーションPK解析で決定される.PKパラメータとしては最高血中濃度(maximum concentration),血中半減期(T1/2)およびAUC(area under the curve)などが算出される.
抗菌薬はそれぞれの薬剤に応じた用法・用量が定められている.この用法・用量は臨床試験の結果から薬物体内動態に基づいて規定されている.しかし,抗菌薬をより有効に使うにはPK/PDの概念に基づいた抗菌薬の用法・用量を考慮する.抗菌薬の血中濃度が原因微生物の最小発育阻止濃度(MIC)を上回る時間(time above MIC)と血中濃度曲線のつくる面積(area under curve:AUC)と最高血中濃度(Cmax)などの関係から,ペニシリン系薬,セフェム系薬,カルバペネム系薬などのβ-ラクタム系薬やテトラサイクリン系薬,オキサゾリジン系薬などはMICを上回る濃度の抗菌薬が長時間存在する方が臨床的に有効であり,投与回数を増やすことでより有効となる.ニューキノロン系薬やアミノグリコシド系薬は血中濃度が高い方が有効であり,1回投与量を多くすることでより有効となる.
c.おもな抗菌薬と特性(表3-1-11)
ⅰ)ペニシリン系薬
ペニシリン系抗菌薬はこれまで抗菌薬の代名詞とされ,およそ30種類弱の薬剤が開発されている.ペニシリン系薬は細菌の分裂増殖に最も重要なペニシリン結合蛋白質(PBP)に結合し殺菌的に作用するが,近年ペニシリン系薬を分解する酵素β-ラクタマーゼを産生する菌やペニシリン系薬が結合できないPBPをもつ耐性菌が増加しつつある.そのような耐性菌にはβ-ラクタマーゼ阻害薬配合ペニシリン系薬が有効となる.ペニシリン系薬は黄色ブドウ球菌(メチシリン耐性黄色ブドウ球菌を除く),インフルエンザ菌,Moraxella catarrhalis,淋菌などに有効である.多くの薬剤は腎排泄性で,副作用としてアレルギー反応に注意する.その他,肝機能障害や腎機能障害,神経症状などの副作用を認めることがある.
ⅱ)セフェム系薬
セフェム系薬は殺菌性にすぐれ,抗菌スペクトルが広く,副作用が少ない安全性の高い薬剤である.セフェム系薬はその特徴から第1世代,第2世代,第3世代,第4世代と便宜上分類されている.第1世代セフェム系薬はGram陽性菌にすぐれた抗菌活性を示すが,インフルエンザ菌や腸球菌には抗菌活性が劣る.第2世代セフェム系薬は第1世代セフェム系薬に比較してGram陰性菌の抗菌スペクトルが拡大し,第3世代セフェム系薬はβ-ラクタマーゼに安定で,Gram陰性菌の抗菌スペクトルが拡大したが,Gram陽性菌の抗菌力は弱くなった.第4世代セフェム系薬は緑膿菌も含んだGram陰性菌の抗菌力がさらに増強され,同時にGram陽性菌の抗菌力も強くなった.セフェム系薬の多くの薬剤は腎排泄性であるが,セフォペラゾンなど一部の薬剤は胆汁排泄性である.副作用は抗菌薬のなかでも最も少ない薬剤とされペニシリン系薬と同様にアナフィラキシーや薬剤性の発熱や腎機能障害などに注意が必要となる.
ⅲ)アミノグリコシド系薬
アミノグリコシド系薬は抗菌スペクトルや抗菌力にすぐれているが,腎毒性や聴力障害などの副作用のため,第2選択薬と考えられている.しかし,最近は血中濃度を随時測定し,適切な投与量を設定し,副作用の軽減をはかる(therapeutic drug monitoring:TDM)の導入や,1日1回の投与法によって有効性を落とすことなく,副作用の軽減をはかる投与法などが工夫されている.アミノグリコシド系薬は短時間に強力な殺菌作用を示し,低濃度でも細菌を増殖抑制するpost antibiotic effect(PAE)を示す.大腸菌,肺炎桿菌,プロテウス,セラチアなどの腸内細菌群にすぐれた抗菌力を示し,Gram陽性菌ではブドウ球菌にはすぐれた抗菌力を示すが,肺炎球菌や腸球菌には抗菌力が劣る.腎排泄性で,胆汁中へ移行せず,直接刺激性が低いため,腹腔内や髄液内に局所投与されることもある.副作用として腎機能障害を高率に認める.また,耳毒性も注意が必要で,めまい,悪心,嘔吐,眼振などの前庭機能障害と難聴などの聴力障害を認める.
ⅳ)ニューキノロン系薬
本来キノロン系薬はGram陰性菌にのみ抗菌力を有していたが,化学組成を変化させブドウ球菌や肺炎球菌などのGram陽性菌にも抗菌力をもつニューキノロン系薬が開発された.組織移行性や細胞内移行性も良好なため,マイコプラズマ,クラミジア,レジオネラなどにも有効である.副作用として光毒性を認める薬剤があり,服用時は直射日光を避ける.その他,痙攣,低血糖,横紋筋融解症,急性腎不全などの副作用がある.また,非ステロイド系抗炎症薬やテオフィリン薬との相互作用に注意が必要となる.
ⅴ)テトラサイクリン系薬
ミノサイクリンとドキシサイクリンはテトラサイクリン系薬であり,マイコプラズマ,クラミジア,リケッチアなどのβ-ラクタム系薬が無効な原因微生物に有効である.さらにコレラ,ライム病,ブルセラ症など輸入感染症にも有効な薬剤である.テトラサイクリン系薬はブドウ球菌,溶連菌,肺炎球菌などのGram陽性菌とインフルエンザ菌,大腸菌,肺炎桿菌,赤痢菌などGram陰性菌のほか嫌気性菌にも抗菌力を示す.胆汁排泄性で胆道感染にも有効であるが,肝機能障害の患者では注意が必要となる.発疹やアナフィラキシーなどの過敏反応,悪心,嘔吐などの消化器症状や肝機能障害などの副作用をときに認める.また妊婦や新生児から小児までの低年齢児への投与は催奇形性やキレート形成による骨発育不全,歯牙の着色エナメル質の形成不全を起こすことがあるため,原則的には投与できない.
ⅵ)マクロライド・クリンダマイシン系薬
マクロライド・クリンダマイシン系薬は細菌細胞内のリボソームの50Sサブユニットに結合し,蛋白合成阻害によって抗菌活性を示す.Gram陽性菌ではブドウ球菌,肺炎球菌,連鎖球菌,腸球菌などに抗菌力を示すが,肺炎球菌には耐性化が進んでいる.また,マクロライド系薬は百日咳,レジオネラ,マイコプラズマ,クラミジア,リケッチアにも抗菌力を有し,クリンダマイシンは嫌気性菌に強い抗菌力を示すことも特徴の1つである.副作用は食欲不振,胃部不快感,下痢などの消化器症状や肝機能障害,皮疹などを認めるが,重篤なものは少ない.
ⅶ)カルバペネム系薬
カルバペネム系薬はβ-ラクタム系薬で広い抗菌スペクトル,強力な抗菌活性,β-ラクタマーゼに対する高い安定性などをもつすぐれた抗菌薬である.Gram陽性菌では連鎖球菌,肺炎球菌(ペニシリン耐性肺炎球菌を含む),黄色ブドウ球菌などにすぐれた抗菌力を示すが,メチシリン耐性黄色ブドウ球菌(MRSA)には抗菌力がない.腸内細菌をはじめGram陰性菌にもすぐれた抗菌力を示し,さらに緑膿菌やセフェム系薬の耐性が問題となっているエンテロバクター,セラチア,シトロバクターなどの菌種にも有効である.嫌気性菌にもすぐれた抗菌力を示す.腎排泄性で腎機能低下例や高齢者では投与量を減量する必要がある.副作用は痙攣,意識障害などの中枢神経系障害と腎機能障害に注意が必要である.
ⅷ)ST合剤
ST合剤は持続性サルファ剤のスルファメトキサゾール(SMX)と2,4-ジアミノピリミジン系薬トリメトプリムの合剤である.Gram陽性菌やGram陰性菌のほかにノカルジアやトキソプラズマにも抗菌力を示す.また,ニューモシスチス肺炎にも有効である.副作用は悪心,嘔吐,食欲不振,下痢,便秘,舌炎,口角炎などの消化器症状を認める.さらに長期使用では白血球減少,血小板減少,貧血などの造血器障害に注意が必要となる.
ⅸ)抗MRSA薬
バンコマイシンとテイコプラニンはグリコペプチド系の抗MRSA薬である.尿排泄性で髄液中にはほとんど移行しない.副作用として腎機能障害があるため,血中濃度をモニタリング(TDM)し,至適用量を決定する.また急速静注でヒスタミンが遊離され,顔面,上腕,体幹上部に瘙痒感と熱感を伴う紅斑や発疹を伴うレッドネック症候群を認める.アルベカシンはアミノグリコシド系薬として,MRSAに抗菌活性を示す.肺への移行性が不良で,腎機能障害を認めることもある.リネゾリドはバンコマイシン耐性腸球菌(VRE)の治療薬であったが,MRSAに対してもすぐれた抗菌活性を有している.2週間以上の投与に際しては,血球減少症を伴うことが多い.ダプトマイシンはわが国で最近使用可能となった薬剤である.MRSAに対して殺菌的に作用するが,肺ではサーファクタントで不活化されるため,MRSA肺炎には無効である.
d.抗真菌薬
抗真菌薬は真菌感染症の治療薬である.内科系疾患の真菌感染症はカンジダ属やクリプトコックスなどの酵母状真菌とアスペルギルス属などの糸状菌による感染症がおもなものである.真菌はヒトの細胞と同様の真核生物であるため,抗真菌活性を有する抗真菌薬は,ヒト細胞にも作用することが,副作用として現れ,安全性に問題があったが,抗真菌活性にすぐれ,同時に安全性にもすぐれたアゾール系抗真菌薬が臨床使用されてから,多くの真菌感染症の治療に用いられるようになった.
ⅰ)ポリエン系薬
ポリエン系薬であるアムホテリシンBは,酵母状真菌から糸状菌まで,幅広い抗真菌スペクトルをもち,殺真菌活性にすぐれた薬剤である.しかし,発熱,腎機能障害,低カリウム血症などの副作用が高頻度に認められるため,臨床的に使いづらい薬剤であった.その副作用を軽減するため,アムホテリシンB脂質製剤が開発され,より高用量の薬剤が,より安全に投与可能となった.
ⅱ)フルシトシン
フルシトシンは酵母状真菌のみに抗真菌活性をもつ経口薬であるが,現在ではほかに有効な経口薬が臨床使用可能となったため,実際の臨床現場ではほとんど使用される機会はなくなった.
ⅲ)アゾール系薬
アゾール系抗真菌薬は真菌細胞壁のステロール合成系を阻害することによって,抗真菌活性を示す.フルコナゾールは酵母状真菌に有効であるが,糸状菌には無効である.安全性にすぐれ,注射薬と経口薬が使用可能である.イトラコナゾールはアスペルギルス属などの糸状菌にも有効な抗真菌薬である.剤型としては,カプセル剤,口内溶液,注射薬があり,カプセル剤は十分な血中濃度に達しない症例もある.ボリコナゾールはアスペルギルス属などの糸状菌に対してきわめてすぐれた抗真菌活性を示し,侵襲性肺アスペルギルス症においては第一選択薬とされる.投与に際しては視覚障害や肝機能障害に注意する.
ⅳ)エキンキャンディン系薬
最も新しく開発された抗真菌薬である.ミカファンギンは酵母状真菌から糸状菌まで多くの真菌に対してすぐれた抗真菌活性を有している.安全性にもすぐれているが,注射薬のみが使用可能である.重症例では,アゾール系薬やポリエン系薬と併用投与されることもある.カスポファンギンもミカファンギンと同様の抗真菌活性を有する薬剤で,わが国では最も新しく使用可能となった抗真菌薬である.
e.抗寄生虫薬
抗寄生虫薬としては,原虫症薬と蠕虫症薬に大別される.蠕虫症薬はさらに吸虫,条虫,線虫,外部寄生虫に応じて有効な薬剤がある.原虫症薬はマラリア,トリコモナス症,赤痢アメーバ症,ランブル鞭毛虫症などの感染症の治療に用いられる.原虫症の中でもマラリアは重要な疾患であり,特に近年増加しつつある熱帯熱マラリアに対しては適切な治療を行わないと死の転帰となることがある.ほかの原虫症薬は感染した寄生虫の種類によって,投与量が異なるため注意が必要である.多細胞生物である吸虫,条虫,線虫をまとめて蠕虫とよぶ.蠕虫症には蠕虫薬が投与される.外部寄生虫症としては,疥癬症とハエ症がある.疥癬症にはこれまで外用薬が使用されてきたが,現在は,内服薬であるイベルメクチンが臨床的に使用可能となった.抗寄生虫症薬は実際には有効であっても,保健適応外の薬剤が多く,また症例数がきわめて限られているため,有効な薬剤は一般的には入手できない.そのため,国内で入手できない薬剤に関しては,「熱帯病治療薬研究班」が輸入し,保管しているため,必要に応じて連絡し,使用可能である.
(3)抗ウイルス薬
(antiviral drug) ウイルスは宿主細胞に侵入し,感染が成立する.また,感染したウイルスは細胞内で増殖後,放出され,新たな細胞へ感染する.抗ウイルス薬はウイルスの細胞への吸着,ゲノムの脱殻,転写および複製,蛋白質合成,粒子の形成と放出など増殖過程のいずれかの段階を阻害することによって,抗ウイルス活性を発揮する.抗ウイルス薬は抗菌薬に比べて,その種類もきわめて限られており,また特定のウイルスにのみ効果を認める薬剤が多い.さらに,ウイルスは感染した細胞を利用し,増殖するため,抗ウイルス薬はウイルスの増殖抑制作用のみならず,宿主細胞における毒性から,多くの副作用を認めるため,注意が必要となる.
a.抗ヘルペスウイルス薬
ヘルペスウイルスには,単純ヘルペスウイルスと水痘・帯状疱疹ウイルスがある.わが国で使用可能な抗ヘルペスウイルス薬は,アシクロビル,バラシクロビル,ファムシクロビル,ビダラビンである.アシクロビルはグアノシンアナログで,感染細胞の中でウイルス由来のチミジンキナーゼにより一リン酸化され,さらに細胞由来のチミジンキナーゼにより三リン酸化され,アシクロビル三リン酸となり,DNAポリメラーゼにより,ウイルスDNAの3'末端に取り込まれ,ウイルスDNAの伸長を停止し,ウイルスDNAの複製を阻害する.単純ヘルペス,骨髄移植におけるヘルペスウイルス感染症の発症抑制,帯状疱疹の治療薬として,経口および点滴静注される.また,脳炎や髄膜炎の患者では,投与量の増量や,投与期間の延長が必要となる.正常細胞への毒性は比較的少ないが,腎障害のある患者では腎機能障害を認める.バラシクロビルはアシクロビルのプロドラッグである.バイオアベイラビリティは50%程度向上し,アシクロビルより高い血中濃度が得られる.ファムシクロビルは経口薬で,服用後速やかに代謝され,活性代謝物ペンシクロビルに変換され,ウイルスのDNAポリメラーゼを阻害し,増殖を抑制する.神経障害や,重篤な皮膚障害に注意が必要である.ビダラビンは強力なDNAポリメラーゼ阻害作用を有するため,一般的には免疫抑制患者における単純ヘルペス脳炎や角膜炎の治療に用いられる.また,アシクロビル耐性ウイルスにも有効である.
b.抗サイトメガロウイルス薬
わが国で使用可能な抗サイトメガロウイルス薬は,経口薬のバルガンシクロビル,注射薬のガンシクロビルとホスカルネットがある.バルガンシクロビルはガンシクロビルのプロドラッグであり,体内で吸収された後,直ちにガンシクロビルになる.吸収にすぐれ,バイオアベイラビリティは60%程度である.ガンシクロビルは強力なDNAポリメラーゼ阻害作用により,抗ウイルス活性を示す.サイトメガロウイルス網膜炎やAIDS,臓器移植における重篤なサイトメガロウイルス感染症の治療に用いられる.ホスカルネットはガンシクロビル耐性ウイルスにも有効であるため,ガンシクロビルの代替薬として使用される.ガンシクロビルとバルガンシクロビルは用量依存的に骨髄抑制を認め,汎血球減少や貧血を生じる.また,不可逆的な精子形成機能障害や,婦人の妊娠性低下を招く.ホスカルネットは重篤な腎機能障害を認めることに注意する.
c.抗RSウイルス薬
遺伝子組換え由来RSウイルスのF蛋白質上の抗原部位A領域に対する特異的ヒト化モノクローナル抗体であるパリビズナブは,新生児,乳児および幼児におけるRSウイルス感染による重篤な下気道感染症の発症を抑制する抗ウイルス薬として使用される.
d.抗インフルエンザウイルス薬
インフルエンザウイルス感染症の治療薬としては,ウイルス核酸の脱殻を阻害するアマンタジンと,インフルエンザウイルスのノイラミダーゼ活性を選択的に阻害し,ウイルスの細胞からの遊離を阻害するノイラミダーゼ阻害薬として,オセルタミビル,ザナミビル,ペラミビル,ラニナミビルの4薬剤がある.さらに,インフルエンザウイルスのRNAポリメラーゼ活性を阻害する新しい作用機序を有するファビピラビルが開発された.現在のインフルエンザ感染症治療の主流はノイラミダーゼ阻害薬であり,剤型も経口薬であるオセルタミビル,吸入薬であるザナミビル,ラニナミビル,注射薬であるペラミビルがあり,患者の重症度や服薬コンプライアンスから薬剤を選択することが可能である.しかし,オセルタミビルなどのノイラミダーゼ阻害薬は10歳以上の未成年において服薬後に異常行動が起こることが報告され,この年代の患者に投与する際には十分な注意が必要となる.
e.抗HIV(human immunodeficiency virus)薬
現在,臨床的に使用可能な抗HIV薬には,核酸系逆転写酵素阻害薬(NRTI),非核酸系逆転写酵素阻害薬(NNRTI),プロテアーゼ阻害薬(PI),インテグラーゼ阻害薬(INI),CCR5阻害薬などさまざまな薬剤がある.抗HIV療法の目標は,血液中のHIV量を最大限かつ長期間にわたって検出限界以下に抑え続けることによって,免疫能を回復・維持し,患者の生活の質(quality of life:QOL)を改善し,HIV関連疾患および死亡を減らすことである.治療にあたっては,AIDS指標疾患を発症している場合およびCD4陽性Tリンパ球数が350 cells/μL以下の場合は抗HIV療法を開始する.単独の抗HIV薬で治療を行うと,急速に薬剤耐性を獲得してしまうため,必ず,多剤併用療法を行う.また,治療を成功させるためには,高い服薬コンプライアンスを維持することが重要である.HIV/AIDS診療に関する医学的知見は日々変化しており,常に最新版の治療ガイドラインを参照する必要がある.
(4)抗癌薬
a.抗癌薬の使用法
悪性腫瘍の治療目的で薬剤を投与することを癌の化学療法といい,抗腫瘍効果のある薬剤を抗癌薬とよぶ.白血病や悪性リンパ腫など造血器悪性腫瘍の治療においては化学療法が中心的な役割を果たし,薬剤感受性が高い症例においては治癒が期待できる.また胃癌・大腸癌や肺癌などの固形腫瘍においても外科的腫瘍切除や放射線照射療法と組み合わせて化学療法が行われる.固形腫瘍における患者生命予後は多くの場合外科治療の有効性にかかっているが,近年は新規薬剤および有効な多剤併用療法の開発に伴い,固形腫瘍においても化学療法の重要性は増してきている.実際,精巣腫瘍や乳癌などでは化学療法の有効性が治癒への重要なポイントとなる.また外科治療を行っても多発転移巣などのために治癒が期待できない患者の場合は,しばしば延命あるいはQOLの向上を目的とした化学療法が行われる.
一般的な抗癌薬は細胞傷害性の強い毒物である.しかも現在の化学療法の主体は多剤併用療法であり,用いる薬剤の組み合わせも疾患によって大きく異なる.したがって実際に抗癌薬を患者に用いる医師は,薬剤の有効性・副作用に十分な知識があり,化学療法の実地教育を受けた者でなくてはならない.今日の多剤併用プロトコールは,作用機序の異なる,交差耐性の少ない薬剤が組み合わせて用いられ,癌細胞に対して最大の殺細胞効果が目指される.したがって投与薬剤の選択は対象疾患・患者に応じて科学的根拠に基づき理論的に行われる(evidence-based medicine:EBM)必要がある.また近年,特定の癌関連分子を標的とした分子標的治療薬が次々と開発され,固形腫瘍の治療においても重要な役割を果たすようになった.これらの情報は,基本的に患者に病名を告知した上で開示され,インフォームドコンセントが得られたもとで治療が行われるべきである.
実際の使用にあたって抗癌薬の投与量は,対象患者の年齢,体表面積,体重,全身状態(performance status:PS),および主要臓器(心臓,肺,肝臓,腎臓)の機能に応じて勘案される.薬剤投与経路は経口あるいは経静脈による全身投与が一般的であるが,脳脊髄腔,胸腔,腹腔などに局所投与される場合もある.十分な効果を上げるためには抗癌薬の腫瘍局所における有効濃度を上昇させることが重要であり,薬剤の投与法(drug delivery system)の最適化がなされるべきである.
多くの抗癌薬が重篤な副作用をもたらすため,適切な補助療法を施行することが化学療法の成功にきわめて重要である.具体的には,制吐薬の投与,造血障害に対する輸血,感染症治療,補液などが行われる.化学療法に伴う重篤な顆粒球減少症に対しては顆粒球コロニー刺激因子(granulocyte colony-stimulating factor:G-CSF)の投与も行われる.
また最近では悪性腫瘍に対する治療の有効性が増して治癒例が多くなるにつれ,癌治療自体による二次発癌が問題となってきた.二次発癌は化学療法および放射線照射療法のいずれによっても生じ,治療後数年後から発生しうる.具体的には,固形腫瘍,白血病,骨髄異形成症候群などさまざまな癌が二次性に生じ,多くは治療抵抗性である.
b.抗癌薬の種類と副作用(表3-1-12)
従来使用されてきた抗癌薬は基本的に細胞毒であり,それぞれの薬剤に第Ⅰ相臨床試験で明らかにされた用量規定因子が存在する.なかでも骨髄抑制(シスプラチンとブレオマイシンが重要な例外)と悪心嘔吐はしばしば認められる.しかし近年開発応用されてきた分子標的治療薬は,多くの場合特定の蛋白を標的としており,正常細胞への副作用が少ないことが多い.
ⅰ)細胞毒性抗癌薬
1)アルキル化薬:
標的細胞のゲノムDNAおよび蛋白をアルキル化しDNAの架橋を誘導することで,DNA複製・RNA転写を阻害する.化学療法に広く用いられており,骨髄抑制による血球減少が主たる副作用である.シクロホスファミドによる出血性膀胱炎,ブスルファン長期投与における肺線維症が認められる.
2)白金化合物:
白金化合物もアルキル化薬と同様にゲノムDNAをアルキル化することで細胞増殖を阻害する.さまざまな固形腫瘍の治療薬としてきわめて重要である.シスプラチンは骨髄抑制が軽度であるが腎毒性が強く,使用の際は尿量の確保が必須である.一方,シスプラチンの誘導体であるカルボプラチンは腎毒性は弱く骨髄抑制が用量規定因子である.
3)代謝拮抗薬:
核酸合成経路における基質や酵素に似た化合物で,核酸合成経路に取り込まれた後その経路を阻害する.DNA合成を阻害するため細胞周期を考慮した投与スケジュールが必要である.造血器悪性腫瘍,固形腫瘍共通に用いられ骨髄抑制が主たる副作用であるが,メトトレキサートの口内炎とl-アスパラギナーゼの肝障害が重要である.
4)抗腫瘍性抗生物質:
菌が産生する物質の中で抗癌薬として用いられるものであり,アントラサイクリン系とそれ以外に分かれる.前者は強い骨髄抑制作用をもつが,多くの癌に対して抗腫瘍活性も高い.アントラサイクリン系薬剤の副作用として心筋障害が重要であり,同薬剤によるうっ血性心不全はしばしば致死的である.心筋障害の発生は薬剤総投与量に依存しており,使用に際しては累積投与量を常に注意しなくてはならない.また非アントラサイクリン系薬剤のブレオマイシンは骨髄抑制がないがしばしば重症の肺線維症を生じる.
5)植物アルカロイド:
植物由来物質で抗腫瘍活性をもつものであり,ビンクリスチン,ビンブラスチンはチュブリンと結合して微小管の形成を阻害し,パクリタキセルは逆に非機能性の微小管を形成して細胞分裂を阻害する.またイリノテカン,エトポシドはそれぞれトポイソメラーゼ-Ⅰ,-Ⅱの阻害薬である.ビンクリスチンの末梢神経障害,パクリタキセルの過敏反応,イリノテカンの下痢が特徴的な副作用である.エトポシドは二次発癌の原因薬剤としても重要である.
ⅱ)分子標的治療薬(図3-1-15)
正常細胞の増殖は,細胞外からの成長因子刺激により成長因子受容体が活性化され,そのシグナルが核内へ伝達されて,細胞増殖を制御する遺伝子の発現が誘導されることにより生じる.悪性腫瘍においてはこのメカニズムの一部および細胞死を誘導するメカニズムの一部に異常が生じて,恒常的細胞増殖が生じていると考えられており,そのような異常部位を標的とした治療法のことを分子標的治療とよぶ.真に癌固有の遺伝子・蛋白異常を選択的に阻害することができれば,旧来の細胞毒性抗癌薬よりはるかに副作用が軽減されると期待される.実際イマチニブ,オールトランス型レチノイン酸(all-trans retinoic acid:ATRA),リツキシマブなどできわめてすぐれた薬効が確認された.なお多くの分子標的治療薬は特定の標的分子陽性症例に対してのみ投与されるべきである.
1)モノクローナル抗体:
成熟Bリンパ球の表面にはCD20蛋白が存在するが,CD20に対するモノクローナル抗体(リツキシマブ)の結合により細胞死が誘導される.リツキシマブを含む治療はCD20陽性悪性リンパ腫に対して現在第一選択プロトコールの一種となっており,主たる副作用は過敏反応と腫瘍崩壊症候群である.また乳癌細胞表面に発現しているHER2に対しても同様にモノクローナル抗体(トラスツズマブ)が開発されており,HER2陽性乳癌に対して有効性が確認された.さらに細胞表面CCR4蛋白に対するモノクローナル抗体であるモガムリズマブが成人T細胞白血病の治療に用いられる.また血管内皮増殖因子(vascular endothelial growth factor:VEGF)に対する抗体であるベバシズマブは,腫瘍の血管新生を阻害して細胞増殖を抑制する薬剤であり,大腸癌,肺癌などに用いられる.
2)チロシンキナーゼ阻害薬:
慢性骨髄性白血病においては疾患特異的な染色体転座t(9;22)の結果BCR-ABL融合遺伝子が生じ,ABLチロシンキナーゼ活性が上昇する.ABLに対する選択的阻害薬であるイマチニブは慢性骨髄性白血病未治療例の過半数に細胞遺伝学的寛解を誘導可能であり,同疾患の第一選択薬となっている.またイマチニブはKITチロシンキナーゼも阻害可能であるが,KIT遺伝子の配列異常によって生じる消化管間質腫瘍(gastrointestinal stromal tumor:GIST)に対しても有効である.上皮成長因子受容体(epidermal growth factor receptor:EGFR)はチロシンキナーゼ活性をもつが,活性型EGFR変異陽性の非小細胞肺癌に対して本蛋白阻害薬であるゲフィチニブ・エルロチニブが有効である.また非小細胞肺癌の一部はEML4-ALK融合型チロシンキナーゼ陽性であり,これら肺癌にはALK阻害薬であるクリゾチニブが有効である.
3)転写調節薬:
急性前骨髄球性白血病(APL)においては特徴的な染色体転座t(15;17)の結果PML-RARA融合遺伝子が生じ,レチノイン酸受容体による正常な転写制御が破綻して前骨髄球の分化がブロックされる.ATRA投与はこのレチノイン酸受容体の機能を回復することにより悪性前骨髄球を分化させる治療法である.一方難治性APLに対して亜ヒ酸が有効であり,その作用機序は不明であるものの,PML-RARA蛋白の分解に関与していると考えられている.なお癌細胞の多くで,ゲノムDNAのメチル化異常,染色体ヒストン蛋白のアセチル化・メチル化異常が生じていると考えられている.これらエピジェネティック異常を制御する薬剤の1つとしてDNAメチル化阻害薬であるアザシチジンが開発され,骨髄異形成症候群に有効であることが確認された.
4)その他の分子標的治療薬:
細胞増殖の重要な制御蛋白であるRASに対する阻害薬や,血管新生阻害薬,さらに細胞内蛋白分解システムであるプロテアソームの阻害薬が,多くの癌に対して臨床研究の段階にある.中でもプロテアソーム阻害薬であるボルテゾミブの難治性多発性骨髄腫に対する有効性が確認されている.
(5)非ステロイド系抗炎症薬(NSAIDs)
a.定義・作用機序
非ステロイド系抗炎症薬(nonsteroidal anti-inflammatory drugs:NSAIDs)は,ステロイド以外で抗炎症作用をもつ薬剤の総称である.しかし,通常NSAIDsとはシクロオキシゲナーゼ(COX)の阻害によりプロスタグランジン(PG)の産生を抑制し,鎮痛,解熱,消炎症作用および血小板凝集抑制作用を有する薬剤のことを意味している.
b.適応症
疼痛の制御を目的に,術後・抜歯後痛,外傷痛,癌性疼痛,神経痛さらに月経痛などに対して用いられている.さらに膠原病などの結合組織の慢性炎症を特徴とする全身性疾患では,抗炎症,解熱,さらに関節痛の制御を目的に広汎に用いられている.また,その抗血栓・抗血小板作用も臨床的に有用で,脳梗塞,虚血性心疾患,抗リン脂質抗体症候群(APS)などの予防や治療に用いられている.その他,PG合成抑制作用により,腎血流量を減少させて蛋白尿を減少させたり,エンドトキシンショックや動脈管の開存などの治療に用いられる.
c.NSAIDsの分類
NSAIDsはその化学構造から約10群に分類され,さらに最近報告されたCOXのアイソザイム,COX-1とCOX-2に対する特異性から2群に分けられる.また,血中半減期や剤形もしくは広義のdrug delivery system(DDS)などの相違によっても分類される.ここでは臨床的に重要な血中半減期,剤形およびCOX-2に対する選択性による分類について述べる.
1)血中濃度半減期による分類:
NSAIDsはその化学構造に応じて,血中濃度半減期の長さが異なり,3群に分類される(表3-1-13).一般に,半減期の短い薬物は速効性で,薬効はやや弱いが副作用も少ない.それに対して,半減期の長い薬物は短い薬物よりやや遅効性ではあるが薬効は強く副作用も多い傾向があり,腎・肝などの内臓臓器障害のある患者や高齢者にはあまり好ましくない.
2)剤型(もしくはDDS)による分類:
同じ薬物でも,副作用を軽減させたり,効果の発現を速めるために,多種の剤型がつくられている.徐放性製剤は消化管内で徐々に溶出吸収され,長時間血中濃度が維持されるため薬効が持続し,血中濃度の急激な上昇がないため中枢神経症状などの副作用も少ないとされている.一方,プロドラッグとよばれる薬剤は,不活性体として胃腸粘膜から吸収され,肝臓や炎症部位局所で代謝されて活性体に変わるため,吸収時の直接的なPG生合成阻害作用がなく,胃腸障害が少ない.
これらの内服薬に対し,坐剤は直腸粘膜を通して薬物の吸収を狙った製剤で,経口投与時の直接的な胃腸障害が少なく,一般に吸収が良好で速効性がある.また,吸収後その大部分が腸管静脈から直接下大静脈に入るため肝での代謝を受けにくく不活性化されたり胆汁中に排泄されたりするようなむだになる部分が少ないとされている.
NSAIDsには注射剤もあり,速効性を有し,作用も強力ではあるが,関節リウマチなどの慢性炎症性疾患の治療には用いられていない.注射製剤には,薬物をリピッドマイクロスフェアに封入し,炎症巣特異的に取り込まれるように調整した,ターゲット製剤とよばれるものもあり,作用の増強効果が認められるとされている.
また,有効成分が経皮的に吸収されるように工夫された,パップ剤,軟膏,液剤などの外用剤が用いられている.局所作用のみで全身作用がほとんどなく,腱・腱鞘炎,粘液包炎など皮下浅部の関節近傍軟部組織における疼痛や炎症に対して有用とされている.
3)COXアイソザイムに対する選択性の差からの分類:
COXは主としてCOX-1とCOX-2の2種のアイソザイムに分類され,COX-1が血小板凝集,胃酸分泌抑制,胃粘膜保護,利尿,発痛,血圧・血行の維持などの生理作用を有しているのに対し,COX-2は炎症反応,血管新生,排卵,分娩,骨吸収,ショック時の血圧低下,胃潰瘍の修復,アポトーシスなどに関与している.そこで消化性潰瘍などの副作用が起きにくく,骨破壊抑制の効果も期待される合目的な薬剤としてCOX-2選択性NSAIDsが開発されている.現在,わが国で市販されているNSAIDsでは,セレコキシブがこれに相当するが,エトドラクおよびメロキシカムもCOX-2に対する選択性が高い.COX-2選択性NSAIDsは胃腸障害の発症頻度は非選択性薬剤より明らかに低いものの,消炎・鎮痛効果は非選択性薬剤より高いというわけではない.
d.副作用と危険因子およびその対策
副作用はNSAIDsのPG産生抑制に伴うものが多く,用量依存性の傾向がある.頻度に差はあるが,いずれの薬物にも共通してみられる副作用とそれぞれの薬物に比較的特異的に出現する副作用とがある(表3-1-14).これらを予防するために,患者の訴えに留意し,定期的な検査を実施する.
胃腸障害は最も代表的な副作用であるが,高齢者,消化性潰瘍や消化管出血の既往のあるもの,ステロイド薬服用者,心・血管病変の合併者,煙草やアルコールの嗜好者などで発症のリスクが高くなる.また,Helicobacter pylori菌の感染も潰瘍の発生頻度を上昇させる.このような症例では食直後の服用を励行させ,NSAIDs誘発性胃潰瘍に対する有効性のエビデンスが示されているミソプロストールを併用する.また,プロトンポンプ阻害薬の有効性も証明されているが,通常量のH2受容体拮抗薬は無効であることに留意する.さらに,COX-2選択性NSAIDsは胃腸障害の合併率が有意差をもって低いことが欧米の数多くの臨床試験で示されている.しかし,最近問題となっている小腸潰瘍についてはCOX-2選択性NSAIDsでも非選択的な薬剤と同様に問題となる.
一方,COX-2選択性NSAIDsによる血栓形成性の疾患の誘発が指摘され問題となったが,この点についてはアスピリンを除くすべてのNSAIDsでその傾向があることが確認され,いずれの薬剤も虚血性心疾患のリスクの高い症例への投与は注意を要する.また,COX-2選択性NSAIDsと少量アスピリンの併用は胃腸障害の出現率がCOX-2非選択的NSAIDsと同様になり,心筋梗塞のリスクも低下させることができないことも知られている.
腎障害も臨床上重要な問題で,高齢者,腎疾患の既往のあるもの,うっ血性心不全・肝硬変・動脈硬化症・高血圧症などを合併する高リスク群に対しては,少量より投与し,腎機能を定期的に測定するとともに浮腫や体重増加などの出現にも注意しながら徐々に増量する. また,NSAIDsの2剤以上の併用は副作用の頻度のみが増加し,効果の増強は望めないことが明らかになっているので通常は行わない.
(6)免疫療法(IVIG,アフェレーシス)
免疫療法とは免疫担当細胞および免疫担当細胞が産生するサイトカインやケモカイン,抗体などが担う生体の免疫能を修飾することを治療手段とするものである.
アレルギー疾患のように特定の抗原に対する過剰(異常)な免疫反応が疾病の原因である場合には関連する免疫能を抑制し,膠原病など自己に対する免疫能が全身性に亢進している状態では全身的な免疫抑制・修飾が治療の主体を占める.逆に,悪性腫瘍のように疾病の背景に免疫能の低下がある場合には免疫を賦活する免疫療法が行われる場合がある.また,免疫不全症や重症感染症における免疫グロブリンの補充療法(ある種の感染症などに対する特異抗体の補充を含む)や,病因にかかわる物質や細胞を除去するアフェレーシス(apheresis)も免疫療法である.
本項では,これらの免疫機構を修飾する治療法のなかで,特に,免疫グロブリン補充療法(intravenous immunoglobulin:IVIG)ならびにアフェレーシスについて述べる.
a.免疫グロブリン補充療法
IVIGは,高用量のヒト免疫グロブリンを経静脈的に補充する治療法であり,日本では表3-1-15の1)~10)に示す疾患に対して保険収載されているが免疫グロブリンの製剤ごとにその適応が異なる.なお,破傷風,B型肝炎,抗D(Rho)ヒト免疫グロブリンなど筋注用の製剤もある.IVIGは低ならびに無ガンマグロブリン血症に対して補充療法として使用される.同様に,主として抗菌薬との併用で幅広く重症感染症の治療に使用されるが,ヒト血漿は多様な抗ウイルス抗体を含有するため,サイトメガロウイルス(CMV)や水痘・帯状疱疹ウイルス(VZV)に対する抗体を多量に含んだ製剤をそれぞれ特異的な重症感染症に使用することもある.
また,IVIG療法は表3-1-15に示すように,ステロイド・免疫抑制薬など既存治療抵抗性の膠原病などにおける自己免疫反応の抑制や多様な高サイトカイン血症の病態を示す川崎病などにおける炎症性サイトカインの制御を目的として使用される場合もある.それらの作用機序については不明な点も多いが,仮説のまとめを表3-1-16に示す(Kazatchkine,2001).
IVIGの投与法としてはトラフ値を目安に補充される免疫不全症を除き,一般的に400 mg/kg/日を3~5日間点滴投与するが,川崎病のように2 g/kg/日のような場合もある.
なお,IVIG療法の副作用は少ないが,軽度のものでは頭痛・発熱・悪心・胸部不快感・倦怠感など,まれに重篤な副作用としてアナフィラキシー反応と血栓塞栓症がみられる.特に,IgA欠損症症例へのIVIG療法は注意が必要である.血栓塞栓症は,免疫グロブリンによる血液粘度の増加により生じ,まれに脳梗塞・心筋梗塞・肺塞栓などの報告がある.
b.アフェレーシス
血漿から何らかの方法で有害成分を除去し,残余血漿を患者に戻す治療法をプラズマフェレーシス(plasmapheresis:PP)とよぶ.一方,血漿成分の代わりに血球成分を除去する場合は細胞吸着除去療法(cytapheresis)とよび,血液を特殊なビーズ(フィルター)に通すことで炎症や免疫反応にかかわる白血球や顆粒球を選択的に吸着除去する白血球除去療法(leukocytaheresis:L-CAP)や,顆粒球除去療法(granulocytapheresis:G-CAP)が難治性潰瘍性大腸炎や関節リウマチで保険収載されている.このように,血液透析以外の血液浄化療法を総称的にアフェレーシスとよぶ.
PPには,血漿成分すべてを除去してアルブミンや新鮮凍結血漿で置換する単純血漿交換療法(plasma exchange:PE),血漿分離膜で分離した血漿から特定のサイズの物質のみを選択的に除去する二重濾過血漿交換療法(double filtration plasmapheresis:DFPP),リガンドに吸着対象物質を吸着させ血漿中の目的とする物質のみを選択的に除去する血漿吸着療法(plasma adsorption:PA)がある.
血漿交換とは,本来,血液を血漿分離機で血球成分と血漿成分に分離後,病因物質を含む血漿を廃棄して,正常な血漿と置換する治療法でありPEとDFPPを指すが,日本の保険適応上からは多様な疾患で施行される PAも血漿交換療法に含まれている(表3-1-17,3-1-18). PEは,大小の多様な分子の病因物質を除去できることが特徴であるが,多量の置換液が必要となる.一方,DFPPやPAは,病因関連物質を選択的に除去し余剰の血漿を体内に還元できる点でアルブミンの損失を抑制できる利点がある. 実際の治療では,保険適応上,疾患により治療法の限度回数があるが,血漿交換療法の適応疾患は,血液,神経,免疫,肝,代謝,皮膚疾患や薬物中毒など多岐にわたり(表3-1-17),PPにより各疾患の病因に関与する物質および細胞を除去する.
血液疾患では多発性骨髄腫,マクログロブリン血症などにおける血漿粘度を増加させる巨大血漿蛋白をDFPPにより処理する.神経,免疫疾患では,主たる病因となる抗体・免疫複合体などをPAにより処理する.肝性昏睡の原因物質除去などにも血漿交換療法は用いられる.PAのリガンドおよびその吸着対象物質,おもな適応疾患を表3-1-18に示す.
なお,詳細は省略するが,血漿交換療法における臨床上の留意点は多い.たとえば,膠原病では血漿交換療法により抗体産生を活性化するため血漿交換療法を単独で施行することはなく,免疫抑制療法と併用する.また,発生頻度は不明だが,頭痛をはじめ軽症ではあるが多様な副作用が報告されている.
(7)ステロイド薬と治療
a.グルココルチコイドの作用
生体にストレスのない状態では副腎皮質からコルチゾールが1日約20 mg分泌されている.血中コルチゾールは視床下部CRF(corticotropin releasing factor, 副腎皮質刺激ホルモン放出因子),下垂体ACTH(adrenocorticotropic hormone, 副腎皮質刺激ホルモン)に対するネガティブフィードバック調節を受けており,朝高く夜低い日内変動を示す.ショックなど生体に負荷がかかったときには1日約200 mgのコルチゾールが分泌される.グルココルチコイドは脂溶性のため細胞膜を通過でき,細胞質に存在するグルココルチコイド受容体(GR)に結合すると,GRが活性化され核内へ移行する.核内でGRはさまざまな標的遺伝子のプロモーター上に結合,あるいはほかの転写因子と相互作用し,遺伝子の発現を調節,細胞機能を調節することによりその作用を発揮する.GRは全身の組織に分布しており,多くの組織の正常機能発現にグルココルチコイドが必須である.グルココルチコイドは生理量では生体の恒常性を維持するホルモンとして,糖代謝作用(末梢での糖利用を抑制,肝での糖新生の促進,抗インスリン作用),異化作用(蛋白分解促進),脂質代謝作用(血中遊離脂肪酸,コレステロール増加),免疫調節作用(抗炎症,抗アレルギー作用)を発揮する【⇨図12-6-5】.グルココルチコイドの抗炎症作用の分子機構).一方,抗アレルギー,抗炎症,抗腫瘍効果による臨床的治療効果はグルココルチコイドの薬理効果によるもので大量の投与を必要とする.したがって,ホルモン過剰による副作用も出現し,ステロイド薬は常に「諸刃の剣」となることを認識しなければならない.
b.合成ステロイド薬の種類
現在使用されている経口ステロイド(グルココルチコイドを指す)薬を表3-1-19に示す.
ステロイド療法は,コルチゾールの抗炎症作用を利用することから始まったが,大量ではその電解質作用(Na再吸収,K排泄)が現れるので電解質作用のないもの,抗炎症力価の強い合成薬が開発された.合成ステロイド薬は作用時間の長さにより3種に分類され,作用時間の長いものほど,抗炎症力価も高いが,その分,副作用も大きいことになる.コルチゾンや生理的ステロイドであるヒドロコルチゾンは作用時間が短く,デキサメタゾン,ベタメタゾンは長時間作用型で,プレドニゾロン,メチルプレドニゾロンは中間型である.長時間作用型のステロイドはミネラルコルチコイド作用はなく,Na貯留効果はほとんど認めず,下垂体のACTH分泌抑制作用も強い.長時間作用型のデキサメタゾンが高力価の抗炎症作用を示す理由の1つに,デキサメタゾンは血中ではコルチゾール結合蛋白(CBG)と結合せず,遊離型となることがあげられる.
一方,ショック時,副腎クリーゼなどの緊急時,Addison病ではNa維持作用も必要であり,ヒドロコルチゾンを用いる.緊急時にはステロイド薬の静脈投与が必要となるが,水溶性ステロイド薬としては,ヒドロコルチゾン,プレドニゾロン,メチルプレドニゾロン,デキサメタゾン,ベタメタゾンのコハク酸エステルやリン酸エステル製剤がある.ステロイド薬の効果は生体の薬物代謝酵素によっても影響を受ける.経口投与されたステロイド薬は肝臓で一部代謝され,長期間同じ製剤を投与すると特異的な薬物代謝酵素が誘導される.このため,静脈投与に変えたり,ほかのステロイド薬に変更すると,治療効果が発現したり増強することがある.
c.ステロイド療法の適応疾患と使用法
ⅰ)絶対的適応としての副腎不全に対する補償療法
Addison病,下垂体ACTH分泌不全などの副腎不全では生命維持に必須のグルココルチコイドの生涯にわたる代償療法が必要である.一般にヒドロコルチゾン20 mgを日内分泌リズムに合わせて,2/3~3/4を起床時に,残り1/3~1/4を夕方に投与する2分割投与を行う.
ii)薬理学的療法
抗アレルギー,抗炎症,抗腫瘍効果を目的とするもので,表3-1-20に示す疾患が対象となる.ステロイド療法に対して反応性がよくステロイドを第一の選択あるいは比較的積極的に使用する疾患から,必ずしも反応性が一定せず選択肢の1つとして病期病勢に応じてステロイドが使用される疾患がある.薬理量(大量)を必要とするため,副作用出現率の高い長時間作用型を避けて,中間型のプレドニゾロンが中心に用いられる.
一般に,膠原病,間質性肺炎,ネフローゼ症候群,神経筋疾患,眼疾患では疾患の急性期に対しては,十分量のステロイド薬を投与し,寛解導入後,維持量まで漸減し中止ないし少量の維持量を投与する.それに対し,関節リウマチでは増悪期を除いて維持療法のための少量経口投与,気管支喘息では急性増悪期を除いて症状の程度に応じたステロイド吸入,皮膚炎では外用ステロイド薬が中心となる.大量のステロイドを短期間に投与する方法としてステロイドパルス療法がある.プレドニゾロンに比し,Na貯留作用が低く抗炎症力価が高いメチルプレドニゾロンを通常用い,1 g/日を3日間使用し,治療効果をみながら1~3週ごとに繰り返す方法が一般的である.従来のステロイド療法では効果不十分であった疾患で奏効する例がある.また,重症肝炎に対するステロイドの肝動脈動注療法による劇症肝炎への移行抑制など,ステロイド投与法の工夫により高い効果を示す例がある. IgG4関連疾患として統合された自己免疫性膵炎やIgG4関連多臓器リンパ増殖症候群はステロイドが著効する.
d.ステロイドの副作用と対策
ステロイド薬の副作用は一般状態の悪化や生命を脅かす重篤な副作用(major side effect)と軽症副作用(minor side effect)がある.重篤な副作用としては,感染症の誘発・増悪,消化性潰瘍・出血,精神・神経障害,ステロイド糖尿病,ステロイド離脱症候群,骨粗鬆症による病的骨折や大腿骨頭壊死,小児の成長障害であり,軽症副作用はCushing症候群の臨床症状に代表されるもので満月様顔貌,中心性肥満,痤瘡,多毛,皮下出血斑,伸展性皮膚線条,不眠,白内障,ミオパチー,月経異常などである.また,副作用の発現時期も異なるが(表3-1-21),致命的な副作用の大部分が早期に出現するので注意を要する.
ⅰ)感染症の誘発・増悪
リンパ球,単球数と機能の低下,サイトカイン産生の抑制による免疫能低下が易感染性を発生させる.ステロイド薬の量が増すと感染性は級数的に増大する.また,通常は非病原性とされている細菌や真菌による肺炎などの日和見感染を起こすことがある.
ⅱ)消化管合併症
ステロイドによる消化性潰瘍は胃酸分泌亢進,粘液分泌低下,粘膜保護作用低下,肉芽形成低下などにより発症するとされる.ステロイド潰瘍はしばしば無痛性潰瘍(silent ulcer)ともよばれ,突然の消化管出血や穿孔といった致命的な症状で発症する例が多い.ステロイド療法時早期に出現することが多いので,ステロイド投与前後の内視鏡検査,粘膜保護薬とH2受容体拮抗薬やプロトンポンプ阻害薬の投与を行う.
ⅲ)ステロイド糖尿病
ステロイドは肝での糖新生の促進,インスリン分泌抑制やインスリン抵抗性を惹起して糖尿病を発症する.ステロイド糖尿病の治療は糖尿病性昏睡や易感染性,糖尿病合併症の予防のうえで重要である.各種経口血糖降下薬,インスリン製剤によりステロイド長期使用者では食前血糖80~120 mg/dL,食後血糖18 mg/dL以下,HbA1c(JDS値)で6.5%以下,短期使用者で随時血糖200 mg/dL以下を目標とする.
ⅳ)精神変調
ステロイドによる精神症状は投与後早期に出現することが多くステロイド少量によるものは多幸症が多い.ステロイドの大量長期投与では全身性エリテマトーデスによる精神症状との鑑別が困難なことがあり,ステロイド量の変化と症状の変化の相関などにより判断する.
ⅴ)ステロイド性骨粗鬆症
少~中等量のステロイドの長期投与中の患者には必発であり,海綿骨の豊富な椎骨,肋骨,大腿骨頸部が好発部位で,胸腰椎の圧迫骨折,肋骨や大腿骨頸部の骨折をきたす.発症機序は骨芽細胞の分化成熟の抑制を含めた直接的骨形成の低下が主因である.大量のステロイドの投与では骨粗鬆症に加え大腿骨頭壊死をきたすことがある.ステロイド性骨粗鬆症は比較的頻度の高い医原性疾患であり,その予防は重要である.わが国のステロイド性骨粗鬆症に対する管理と治療のガイドラインは【⇨13-6-6)】の図13-6-7を参照.その骨子はステロイドを3カ月以上投与中あるいは投与予定の患者が以下のいずれかに該当する場合,薬物治療を開始する.①すでに脆弱性骨折がある,あるいは,ステロイド治療中に新規骨折をきたしたとき,②骨密度が80%(YAM値)未満のとき,③1日平均投与量がプレドニゾロン換算で5 mg以上のとき.薬物治療は第1にビスホスホネート製剤を使用する.ヒト組み換えPTH(1-34)製剤もステロイド性骨粗鬆症を強力に抑制する.
ⅵ)副腎クリーゼあるいはステロイド離脱症候群
ステロイド薬の長期投与例では,視床下部・下垂体・副腎皮質系の抑制が起こる.ステロイド加療中あるいは加療中止後副腎機能が回復していないときに手術,外傷,重症感染症などのストレスが加わった場合,あるいは急なステロイドの中止ないし減量(withdrawal syndrome:離脱症候群)を行ったとき致死的ショック状態(副腎クリーゼ)に陥ることがある.したがってステロイドの長期投与後の減量・離脱には間欠投与法などを用いて漸減することが重要である.また,ACTH試験により副腎機能の回復を確認後,ステロイドを中止することが望ましい.[小出大介・山崎 力・前﨑繁文・間野博行・髙崎芳成・石ヶ坪良明・髙栁涼一]
■文献
Dresser GK, Bailey DG, et al: Fruit juices inhibit organic anion transporting polypeptide–mediated drug uptake to decrease the oral availability of fexofenadine. Clin Pharmacol Ther, 71: 11-20, 2002.
Neuvonen PJ, Kantola T, et al: Simvastatin but not pravastatin is very susceptible to interaction with the CYP3A4 inhibitor itraconazole. Clin Pharmacol Ther, 63: 332-341, 1998.
日本感染症学会,日本化学療法学会編:抗菌薬使用のガイドライン,協和企画,東京,2005.和田 攻,大久保昭行,他編:感染症診療実践ガイド,文光堂,東京,2011.前﨑繁文:抗菌薬はこう使え,中山書店,東京,2010.
Kazatchkine MD, Kaveri SV: Immunomodulation of autoimmune and inflammatory diseases with intravenous immune globulin. N Engl J Med, 345: 747-755,2001.
Kotoh K, Enjoji M, et al: Arterial steroid injection therapy can inhibit the progression of severe acute hepatic failure toward fulminant liver failure. World J Gastroenterol, 12: 6678-6682, 2006.
髙栁涼一:ステロイド性骨粗鬆症の病態と予防.日本内科学会雑誌,99: 2244-2251, 2010.

表3-1-7

表3-1-8

表3-1-9

表3-1-10

表3-1-11
表3-1-12

表3-1-13

表3-1-14

表3-1-15
表3-1-16

表3-1-17

表3-1-18

表3-1-19

表3-1-20

表3-1-21

図3-1-13
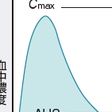
図3-1-14

図3-1-15
薬物療法(腎・尿路系の疾患の治療)
原発性糸球体疾患をはじめとする種々の腎疾患治療には,免疫抑制薬,降圧薬,抗凝固薬,抗血小板薬,抗脂質異常症薬が現在用いられている.これらの薬剤の中で特にエビデンスが豊富なものは降圧薬であり,その有効性はほぼ確立している.一方,IgA腎症に対するステロイドパルス療法,特発性膜性腎症に対する免疫抑制薬投与についても,近年エビデンスが集積しつつあるが,決して高いレベルでのエビデンスとはいえない状況にある(日本腎臓学会:エビデンスに基づくCKD診療ガイドライン2009).
a.免疫抑制薬
腎疾患,特に原発性糸球体疾患の治療において免疫抑制薬は非常に重要な地位を占める.おもに用いられるのは,副腎皮質ステロイドホルモン,アルキル化薬,核酸代謝阻害薬,カルシニューリン阻害薬の4種である.
ⅰ)副腎皮質ステロイドホルモン
腎疾患で最も多く用いられる免疫抑制薬である.抗炎症作用と免疫抑制作用を有し,腎疾患に対する効果の一部は血行動態に対する作用を介する.原発性糸球体疾患では,微小変化群によるネフローゼ症候群,IgA腎症の予後比較的不良群以上の症例,原発性巣状糸球体硬化症,原発性膜性腎症に用いられる.微小変化群における副腎皮質ステロイドホルモンの有効性はきわめて高く,ほぼ全例に投与されるが,減量,中止による再発も多い.小児ではその使用量,使用期間などについてのエビデンスが集積されているが,成人では存在しない.IgA腎症では,予後比較的不良群以上でかつ,血清クレアチニン1.5 g/dL以下の症例で,腎不全が進行していない症例の治療として,メチルプレドニゾロン0.5〜1.0 g/日を3日間投与し,その後プレドニゾロン0.5 mg/kg/隔日で投与するステロイドパルス療法が現在では最もエビデンスレベルが高く(Pozziら,2004),広く行われている.扁桃摘出術を同時に行うか否かについては,現在前向き研究が実施中である.一方,小児では,わが国で行われた前向き無作為化研究によりアザチオプリン,抗凝固薬,抗血小板薬を併用した治療法の有効性が確立している.
原発性巣状糸球体硬化症においては,観察研究の結果を基として副腎皮質ステロイドホルモンが推奨されており,わが国ではプレドニゾロン40 mg/日で4〜8週間の投与が行われており,欧米では,1mg/kg/日で最低4カ月間の投与が行われている.ステロイド単独で寛解が得られない場合,後述のようにカルシニューリン阻害薬との併用が行われる(Cattranら,1999).
原発性膜性腎症の副腎皮質ステロイドホルモン単独療法については,観察研究の結果から,わが国では,プレドニゾロン40 mg/日で4〜8週の投与が推奨されている.しかし,欧米ではメタ解析により無効とする報告があり,一方,研究の計画,対象,投与方法,期間,合併症などの問題から,過去の報告をまとめて分析しても有用な結論は導くことができないという意見も強く,確固とした治療指針が出るにはいたっていない(du Buf-Vereijken,2005).このように意見が分かれる大きな要因は,膜性腎症では自然寛解も多く,さらに進行には10年以上かかることから,短期的な尿蛋白減少を指標としても必ずしも最終の目的である腎不全発症阻止に一致しない可能性があることによる.
ⅱ)アルキル化薬,核酸合成阻害薬,カルシニューリン阻害薬
腎疾患では,この分類に入る薬剤としてシクロホスファミド,アザチオプリン,シクロスポリン,ミゾリビンがおもに用いられている.これらの中では,アルキル化薬であるシクロホスファミドと,カルシニューリン阻害薬であるシクロスポリンが最もよく用いられている.小児IgA腎症では,前述のようにアザチオプリンを用いた併用療法の有効性が確立しているが,成人ではエビデンスが乏しい.微小変化群でステロイド抵抗性,依存性の症例にシクロスポリンが用いられ,効果も確認されているが,エビデンスは乏しい.特発性膜性腎症では,シクロスポリンの単独,ステロイドとの併用の双方の寛解導入作用が証明されているが,単独では再発率が高く,少量ステロイド(0.15 mg/kg/日)とシクロスポリン(3.5 mg/kg/日,トラフ値125〜225 ng/mL)の投与の有効性が報告されている.また,一次性巣状分節性糸球体硬化症においても,ステロイド単独で寛解が得られない場合,特発性膜性腎症と同様のステロイド,シクロスポリン併用が寛解率を高めることが報告されている.なお,わが国では,トラフレベルは100 ng/mL以下として,投与後2時間値が800 ng/mL前後とした方が有効性が高いという報告がある.一方,シクロホスファミドもステロイドとの併用が特発性膜性腎症での寛解率を高めるという報告があるが,シクロホスファミドは出血性膀胱炎,骨髄抑制などの副作用に加え,総内服量が10 g以上となると高率に不妊症を,特に男性不妊を生じやすく,疾患の好発年齢が比較的低いことから,近年は敬遠される傾向にある.また,発癌リスクも高めることが知られている.なお,シクロホスファミドは活性型・不活性型双方の代謝産物がおもに腎臓から排泄されることから,腎機能に応じて減量する必要がある. アザチオプリンは,核酸合成阻害作用を有し,重症の小児IgA腎症で,副腎皮質ステロイドホルモンとの併用が有用であることが報告されているが,成人の場合,あるいは他疾患での使用は確立していない.IgA腎症の進行例,あるいは半月体形成性の場合には有効とする報告がある.膜性腎症では,副腎皮質ステロイドホルモンとの併用を有用とする意見が欧米では多い.
b.血小板阻害薬,抗凝固薬
血小板阻害薬としてはジピリダモールが用いられ,抗凝固薬としてはヘパリン,ワルファリンが広く用いられている.ジピリダモールは免疫抑制薬,抗凝固薬との併用療法で小児の重症IgA腎症での有効性が確認されている.成人のIgA腎症でジピリダモールの単独投与が行われる場合もあるが,有効性は確立していない.ヘパリン・ワルファリンは小児で他剤との併用で用いられるが,単独療法は一般に行われず,また成人では有効性も確立していない.目標とするプロトロンビン時間も確立したものはない.
c.降圧薬
慢性腎疾患での降圧療法の有効性は過去の多くの研究から確立している.特に,レニン-アンジオテンシン系阻害薬,すなわちアンジオテンシン変換酵素阻害薬とアンジオテンシン受容体拮抗薬の有効性に関しては多くの大規模研究の結果から,糖尿病性,非糖尿病性を問わず,慢性腎臓病(CKD)の進行抑制に有効であることが示されている.目標とする血圧は,尿蛋白1 g/日以上の症例では125/75 mmHg以下に,それ以外の症例では130/80 mmHg以下とすることが,日本高血圧学会および米国の治療指針となっており,日本腎臓学会CKD診療ガイドラインでも推奨されている.レニン-アンジオテンシン系阻害薬で目標値とならない場合には,カルシウム拮抗薬,利尿薬が第二選択薬として推奨されている.レニン-アンジオテンシン系阻害薬は,動脈硬化の進んだ症例,腎血管性高血圧の因子をもつ症例では急速に腎機能が悪化する場合があり,投与後しばらくは慎重に腎機能の推移を観察する必要がある.さらに,腎機能がすでに低下した症例,すなわち血清クレアチニン値が2.0 mg/dLをこえる症例では高カリウム血症を生じやすいので,この点も注意が必要である.
d.抗脂質異常症薬
ネフローゼ症候群,CKDでは脂質代謝異常を伴うことから,その治療の有効性が検討されている.特にネフローゼ症候群では,微小変化群による場合は完全寛解にいたれば脂質異常症も改善するが,その他の膜性腎症,巣状糸球体硬化症では長期間脂質異常症が持続することより,その治療の有用性が推測される.しかし,実際には,ネフローゼ症候群を対象とした前向き無作為化試験は行われておらず,抗脂質異常症薬による脂質改善と,腎機能予後に関しては確立していない.一方,CKDに関しては,最近行われた大規模研究では,LDL-コレステロールの薬剤による低下が動脈硬化による合併症を減らすものの,腎機能の低下は有意ではないという結果であった. なお,スタチン系は,腎機能の低下した症例でも,横紋筋融解などの副作用に注意して使用可能であるが,フィブラート系薬剤は血清クレアチニン2.0 mg/dL以上で使用禁忌である.[林 松彦]
■文献
Cattran DC, Appel GB, et al: A randomized trial of cyclosporine in patients with steroid-resistant focal segmental glomerulosclerosis. North America Nephrotic Syndrome Study Group. Kidney Int, 56: 2220-2226, 1999.
du Buf-Vereijken, Branten AJW, et al: Idiopathic membranous nephropathy: outline and rationale of a treatment strategy. Am J Kidney Dis, 46: 1012-1029, 2005.
Pozzi C, Andrulli S, et al: Corticosteroid effectiveness in IgA nephropathy: long-term results of a randomized, controlled trial. J Am Soc Nephrol, 15: 157-163, 2004.
出典 内科学 第10版内科学 第10版について 情報
六訂版 家庭医学大全科 「薬物療法」の解説
薬物療法
やくぶつりょうほう
Pharmacotherapy
(代謝異常で起こる病気)
食事・運動療法は、効果が出るまでに時間がかかることがあります。十分な食事・運動療法を2~3カ月行っても、良好な血糖コントロールが得られない場合は、薬物療法で血糖値の改善を図ります。高血糖が持続すると糖尿病の合併症が起こってきます。血糖値が下がらないのに薬物療法を先延ばしにするのはよくありません。
糖尿病の治療薬(
薬剤で糖尿病自体が治るわけではありません。薬の有効性を維持し、肥満を防ぐために、食事・運動療法の継続が大切です。
なお、糖尿病に効果があるとする民間薬、食品がいろいろ販売されていますが、実際に効果があるものは少なく、怪しいものには手を出さないのが賢明です。
のみ薬
のみ薬は現在7種類あります(表15)。そのほかに、さまざまな配合薬(2種類の薬の成分が含まれているのみ薬)が販売されています。以前はスルホニル尿素薬が最も広く使われていましたが、最近ではDPP4阻害薬が最も使われています。ビグアナイド薬も使用されることが多くなってきました。最も新しいSGLT2阻害薬の処方は徐々に増えています。
●ビグアナイド薬
インスリンのはたらきを改善することで血糖値を低下させる薬です。
インスリンは、肝臓、筋肉、脂肪組織でブドウ糖をグリコーゲンや中性脂肪に変換させることや、肝臓でブドウ糖の合成を抑えることで血糖値を低下させる作用をもちますが、ビグアナイド薬は末梢組織、主に肝臓におけるインスリンのはたらきを改善します。したがって、インスリンはけっこう出ているのにはたらきが悪くなっている人や、とくに太っている人に効果が高い薬です。
ビグアナイド薬は単独では低血糖を起こすことはとても少なく、体重増加も起きにくいことがわかっています。米国やヨーロッパでは2型糖尿病の第一選択薬として広く使われています。
副作用としては、乳酸アシドーシスという血液が酸性になるという異常を起こす可能性がありますが、現在発売されているビグアナイド薬ではまれです。そのほか、軽い胃腸障害が起こることがあります。
●チアゾリジン薬
ビグアナイド薬とは異なる仕組みで、インスリンのはたらきを改善して血糖値を低下させます。
太っている人に効果が高く、単独では低血糖は起こしにくいのですが、浮腫(むくみ)や水分貯留を起こす傾向があり、心臓が悪い人は服用を控えたほうがよいでしょう。体重が増加しやすいので、食事療法を確実に行うことが大切です。
●スルホニル尿素薬
直接、膵臓にはたらきかけてインスリンの分泌を促進します。その効果は長く持続し、1日に1回か2回の服用で血糖値が全体に低下します。2型糖尿病ではインスリン分泌が少し低下することが多いので、理にかなった薬剤なのですが、人によってはごく少量でも血糖値が下がりすぎ、後述する低血糖状態になることがあります。
スルホニル尿素薬のその他の好ましくない点として、食事療法が不十分だと体重が増加しやすいことがあります。また、途中から薬の効きめが悪くなりやすいことも欠点です。このことはスルホニル尿素薬の二次無効と呼ばれますが、インスリン注射への変更の理由として多いものです。
スルホニル尿素薬の服用中でも、食事・運動療法を守ることが大切です。
●速効型インスリン分泌促進薬
スルホニル尿素薬と同じく膵臓からのインスリンの分泌を促進しますが、効果がすぐに現れ、数時間で消失します。
腹部症状は起こりにくいのですが、服用時間がずれると単独でも低血糖を起こすことがあります。
●DPP4阻害薬
インスリンの分泌を促進する消化管ホルモンであるインクレチン(GLP1およびGIP)を増やし、血糖コントロールを改善させます。腸管から分泌されたインクレチンはDPP4という分解酵素によりすみやかに分解されるので、DPP4阻害薬はGLP1とGIPを増やすのです。
インスリンの分泌は増えますが、スルホニル尿素薬とは異なり、血糖値が低い時は効果が弱くなるために、単独では低血糖の可能性はほとんどなく、体重も増加しにくいことがわかっています。血糖値を上昇させるグルカゴンの分泌も減弱させますが、同様に血糖値が低い時は効果が弱くなるために、単独では低血糖を増加させません。低血糖以外の副作用も少なく、ほかの糖尿病ののみ薬との併用もしやすいために広く使われるようになりました。また、糖尿病ののみ薬としては初めて、週1回服用の製剤も発売されています。
●αグルコシダーゼ阻害薬
小腸に存在する
初期の糖尿病の場合には、食後のインスリンの出具合が遅いために空腹時の血糖値があまり高くないのに食後に高血糖になることが多く、そうした人に適した薬です。
また、ほかの血糖降下薬で食後の血糖値が十分に下がらない場合に併用されることも多くあります。最近、食後の血糖値の上昇が動脈硬化を起こしやすくすることがわかり、この薬剤の意義が高まっています。服用は、食後では効果はなく、食事直前にする必要があります。
副作用としては、おなかが張ったり、おならが増えたりすることが多いのですが、服用しているうちにだんだん減ってきます。単独の服用では低血糖を起こすことは少ないのですが、スルホニル尿素薬やインスリンとの併用で低血糖を起こすことがあり、その際は、ブドウ糖を服用します。砂糖は二糖類なので、この薬のはたらきで血糖値が上がりにくいからです。非常にまれですが、副作用として重い肝機能障害が報告されているので、定期的な肝機能のチェックが必要です。
●SGLT2阻害薬
尿糖を増やすことで血糖値を低下させるというユニークな薬です。ブドウ糖は腎臓の近位尿細管にある輸送たんぱく(大部分はSGLT2)により再吸収され、血糖値が170~180㎎/㎗を超えなければ尿糖が出ないしくみになっています。SGLT2阻害薬は尿糖排泄を増加させることで血糖値を低下させます。また、尿中にブドウ糖が排泄されることでエネルギーが失われ脂肪の分解が促進されるので、体重が減少すると考えられています。
インスリンの分泌は増加せず、SGLT1は阻害しないので、単独では低血糖の可能性は少ないと考えられます。一方で、尿糖の増加は膀胱炎などの尿路感染症や性器感染症(とくに女性)をきたしやすいので、注意が必要です。尿糖の増加は利尿作用もあるために脱水を起こしやすいので、水やお茶による適度な水分の補給が必要です。
インスリン注射
●インスリンとは
膵臓から血糖値を下げる何らかの因子が出ていることは、19世紀にはわかっていましたが、ようやく1921年にカナダで血糖値低下作用のある物質が抽出され、インスリンと命名されました。
インスリンはホルモンの一種です。膵臓のなかの一部の細胞(膵
インスリンは、51個のアミノ酸でできたペプチド(たんぱくの一種)で、経口摂取では腸で分解されやすく、血液中に吸収されにくいため、現在のところ注射でしか投与できません。
インスリン注入器は、カートリッジペン型、使い捨てペン型、使い捨てタイマー型が開発され、以前と比べてインスリン自己注射は実行しやすくなっています。針も細く短くなっていて、痛みはさほどではありません。
従来のインスリンは、ブタ、ウシなどの動物の膵臓から抽出していましたが、その後遺伝子工学でつくられるヒトインスリンになりました。最近になり、アミノ酸をヒトインスリンから少し変更したインスリン(インスリンアナログ)も発売され、使用頻度が増えています。
●インスリン注射を行う場合
インスリンの欠点として、注射によるQOLの低下以外にも、低血糖と体重増加があり、これらはスルホニル尿素薬よりも起こしやすくなります。したがって、生活習慣の乱れが大きく影響する2型糖尿病では、インスリン注射はすぐには行いません。
しかし、糖尿病が見つかった時に血糖値がとても高い場合、あるいは非常にやせている場合は、最初からインスリンを使う場合もあります。また、インスリンを使ったほうがよい特別な場合もあります。
肺炎、
発熱、脱水などで血糖値が急に上昇したり、ケトン体という酸性の物質が血液中にたまった場合には、インスリンを使います。最近は、コーラやジュースなどの清涼飲料水やスポーツドリンクの大量摂取で、血糖値が急上昇するケースがよくみられるようになってきました。これらに含まれているブドウ糖、砂糖などが急速に血液中に入るため、この場合もインスリンを使います。
●2型糖尿病でインスリン注射を行う場合
2型糖尿病でも、糖尿病になってからの期間が長くなると、インスリンを使わないと血糖値がうまく下がらないことが多くなってきます。糖尿病自体が進行し、インスリンがだんだん出なくなることが原因として考えられています。
食事・運動療法が不十分であること、およびスルホニル尿素薬の使いすぎは膵臓に負担をかけ、インスリンの出具合をさらに低下させます。のみ薬がうまく効かなくなって血糖値が十分に下がらない場合は、まず食事・運動療法がおろそかになっていないかを確認したうえで、主治医とよく話し合ってインスリン注射への変更を検討します。
いたずらに先延ばしにしてはいけません。血糖値が高いこと自体も、インスリンの出具合をさらに悪くするのです(「ブドウ糖毒性」あるいは「糖毒性」と呼ばれます)。外からインスリンを投与すると、膵臓が休まってインスリンがよく出るようになって、インスリン治療から経口薬治療にもどせる場合もあります。
最もよくないのは、血糖値が高いまま長期間放置し、合併症を進行させてしまうことです。
●インスリン注射のしかた
インスリンは、毎日食事に合わせて決まった時間に腹部、上腕、大腿などに皮下注射で投与します。最初の導入時以外は、家庭で自分自身で注射する自己注射が原則です。インスリン注入器は、前述のように以前と比べて種類も増え、自己注射がしやすくなっていて、入院せずに外来で開始することも多くなってきました。
インスリン治療を開始するにあたっては、実際の注射手技をマスターするとともに、いくつか心得ておかなければならないことがあります。使用しているインスリン製剤の名前、性質、注射する量(単位で表される)、注射時間、注射の場所と方法、注射の際の清潔法、注射液および注入器の保管方法などです。
インスリン製剤には、作用時間の違いによって多くの製品があり、超速効型、速効型、中間型、配合溶解、混合型、
注射の回数、組み合わせは人によってさまざまですが、大まかには超速効型と速効型は食後の血糖値を下げるインスリンとして補充され、中間型や持効型溶解は半日~1日のインスリンを補充し、全体に血糖値を下げます。配合溶解、混合型は、持効型溶解(あるいは中間型)と超速効型(あるいは速効型)が混ざったもので、2型糖尿病の人に1日に通常2回注射することで、食前食後ともに血糖値を改善する目的でよく使われます。
なお、混合型インスリン製剤にはヒトインスリンを使ったものと、インスリンアナログを使ったものの2種類がありますが、食直前に注射するインスリンアナログ混合型を使うことが多くなっています。さらに、最近発売された配合溶解インスリン製剤は持効型溶解と超速効型が混合されていますが、従来の懸濁液である混合型インスリン製剤と異なり、透明な溶解インスリン製剤です。そのため、注射前の混和操作が不要です。
インスリン以外の注射(GLP1受容体作動薬)
●GLP1受容体作動薬とは
糖尿病の注射薬として、インスリン以外にGLP1受容体作動薬があります。すでにDPP4阻害薬のところで述べた、インクレチンという消化管ホルモンの1つであるGLP1のはたらきを強くする薬です。DPP4阻害薬と合わせて、インクレチン関連薬と呼ばれることもあります。
主にインスリンを分泌する膵臓のβ細胞のGLP1受容体に結合して、インスリンの分泌を促進します。さらに、グルカゴンの分泌も低下させます。これらのはたらきにより血糖値は低下しますが、血糖値が低い時は効果が弱くなるために、単独では低血糖はほとんどありません。
GLP1受容体作動薬は、そのほか、胃の内容物の十二指腸・小腸への排出をゆっくりさせるはたらきと食欲を抑えるはたらきもあり、それらによる血糖値の低下作用とともに、体重の低下作用もあります。
●GLP1受容体作動薬の使い方
GLP1受容体作動薬はインスリンの分泌が残っている2型糖尿病が適応です。インスリン依存状態の1型糖尿病ではインスリンによる治療を行います。製剤には、注射の回数が1日1回(朝または夕、あるいは朝食前)、1日2回(朝食前と夕食前)、週1回の3種類があります。副作用として、下痢、便秘、嘔吐などの胃腸症状が使用開始後に認められることが多く、1日1回あるいは2回の製剤の場合は胃腸障害を避けるために徐々に増量します。現在日本で使用されているGLP1受容体作動薬を表16-2にまとめました。
日常生活における血糖測定
●血糖値を自宅で測る
良好な血糖コントロールを目指すために、小さな器械を使って血糖値を自宅で測ることが可能です(血糖自己測定)。少量の血液を指などから採取して、血糖値を短時間で正確に測定できます。
病院で血糖値を測るのは月に数回しかできませんが、日常生活でしばしば血糖値を測ることによって、治療による血糖値の改善が実際にうまくいっているかどうかがチェックできます。これは食事の内容や運動量が血糖値の変動に及ぼす影響も確認でき、低血糖や予期しない血糖値の上昇を知るうえでも有用です。
血糖値を下げる注射薬(インスリン製剤とGLP1受容体作動薬)を使用中の人や、妊娠中の一部の人には保険が適用され、病院から器械、血糖測定チップなどが提供されます。保険適用ではない人でも薬局で購入し、血糖自己測定をする人が増えてきています。おおまかに血糖値が上がりすぎていないかをみるためには尿糖試験紙を購入して、尿糖を自宅でチェックするのもよいでしょう。
インスリンの量や回数は、血糖やHbA1Cをみながら変更することもあるので、定期的な通院が必要です。その際、血糖自己測定での値は治療方針決定に役立つ情報となります。自宅での血糖値に応じて、インスリン量を少し変更することが指示されることもあります。
インスリン治療中は、スルホニル尿素薬使用中よりも低血糖が起こる可能性があります。食事、運動、補食と連動させてインスリン治療を行い、後述する低血糖に対する準備を怠らないことが重要です。インスリン治療は体重も増加しやすいことから、食事・運動療法を守ることが重要です。
●持続血糖測定(CGM)
2010年から、持続血糖測定(あるいは持続血糖モニター、CGM)が1型糖尿病患者と血糖値のコントロールが難しい2型糖尿病患者に対して保険適用となりました。持続血糖測定のセンサーを装着し、連続的に皮下の間質液のグルコース濃度を測定することで、1~2週間にわたる血糖値の変動を推定することができます。血糖自己測定では困難な、夜間の低血糖や食後の血糖値スパイク(食後に血糖値が急上昇すること)を確認することが可能です。センサーを取り外した後に血糖値の変動が解析され、今後の血糖コントロールの改善に役立てられます。2017年には、リアルタイムで血糖値を表示できる機器も日本で導入され、患者自身が血糖値に応じてインスリン量や食事量などを調節して、血糖コントロールを改善し低血糖を減少させることが可能となってきました。
低血糖について
低血糖とは、血液中のブドウ糖が極端に減ってしまった状態です(通常70㎎/㎗以下)。
血液中のブドウ糖は、体のなかのいろいろな組織でエネルギーとして利用されますが、とくに脳はブドウ糖の欠乏に敏感で、機能低下を起こします。大切な脳を守るため、体のなかには低血糖を防ぐ仕組みが備わっており、血糖値が正常範囲より低下すると交感神経の活動が高まります。
血糖降下薬やインスリンを使用していない場合は、交感神経などのはたらきで肝臓などに貯蔵されていたブドウ糖が血中に放出されて血糖値は正常にもどります。しかし、血糖降下薬やインスリンを使用している場合は、血糖値が下がりすぎて脳の活動が低下し、頭痛、集中力の低下、意識障害などが起こってくることがあります。
低血糖が起こる原因としては、薬の量が多すぎた場合もありますが、適切な量の薬を使用している場合でも食事が少なかったり、運動量が多かったりすると低血糖に陥る可能性があります。
低血糖を予防するためには、薬物治療中の人は食事量を守り、運動時には適切な補食をとることが必要です。さらに、ブドウ糖、砂糖、ジュース、糖質の入ったゼリーなどを携帯し、交感神経症状である冷や汗、
がまんすることは禁物です。とくに、自動車の運転時は注意する必要があります。車内に必ずブドウ糖、ジュースなどを常備し、おかしい時には車を安全な位置に停車させて摂取するようにしてください。
出典 法研「六訂版 家庭医学大全科」六訂版 家庭医学大全科について 情報
日本大百科全書(ニッポニカ) 「薬物療法」の意味・わかりやすい解説
薬物療法
やくぶつりょうほう
drug therapy
医薬品(薬物)を用いて各種疾患を治療する方法。
薬物療法の歴史
薬物療法は人類の歴史とともに進化してきた。古代社会や未開社会においては、疾患(悪霊)を体外に出すために呪文を唱える祈祷(きとう)師などが存在していたが、同時に、日ごろの経験則から薬物の原型となる植物・動物・鉱物など自然界にあるものが用いられていた。その後、欧米を中心に、それらの自然界にあるものから、害が少なく、より効き目のある成分(有効成分)が抽出・化学合成されるようになり、さらには抗体医薬、生物学的製剤、遺伝子治療薬など新しい治療薬が医学や薬学の発展とともに生み出され、進化してきた。
一方、中国では欧米とは異なり、自然界にある薬効を有するもの(多くは植物由来)を、精製することなく生薬として用いる薬物療法(体質改善を目的とした漢方医学)が独自に発展し、日本にも漢方医学の形で伝わった。中国のほかにも、世界各地に自然由来の薬効を有する物質をベースとした薬物療法の原型をみることができる。
[北村正樹 2023年5月18日]
薬物の投与方法と剤形
現在使用されている薬物は、投与方法により内用薬、外用薬、注射薬に大別される。
内用薬(内服薬)には、その形状から錠剤、カプセル剤、散剤・顆粒(かりゅう)剤、内服液剤・シロップ剤などの製剤があり、経口的に投与された後におもに小腸から吸収され、肝臓を経由して全身循環血に運ばれ、目的とする臓器や組織へ到達して薬効を発揮する。
外用薬には、皮膚や粘膜などに用いる外皮用剤(パップ剤、テープ剤、軟膏(なんこう)・クリーム剤、外用液剤・ローション剤など)、眼(め)に用いる点眼剤、鼻に用いる点鼻剤、うがい薬としての含嗽(がんそう)剤、肛門に挿入する坐剤、口腔(こうくう)や鼻から吸入する吸入剤などがあり、大部分は人体の局所の炎症、発疹、痛みなどの治療に用いられる。外用薬の製剤のなかでも、解熱鎮痛作用を有する坐剤は局所の痔(じ)疾患以外にも、内服がむずかしい嚥下(えんげ)困難な幼児や高齢者の解熱鎮痛にも有用であり、かつ内服で生じる胃腸障害を軽減する目的でも使用されている。また吸入剤は、肺疾患に対して口腔より吸入することで、直接気道や肺に作用するため、内服薬において生じうる全身性の副作用を軽減できる特徴を有している。
注射薬として用いられる製剤には、注射針を用いて皮下に投与する皮下注製剤、筋肉内に投与する筋注製剤、静脈内に直接投与する静注製剤などがある。注射薬は、直接体内に投与されることで、内服薬などの経口投与に比べて効果発現が速いという特徴がある一方、注射部位からの感染など全身性副作用が生じやすく、注射部位での反応(発疹、発赤、疼痛(とうつう)など)も起こる可能性がある。
[北村正樹 2023年5月18日]
薬物の有効性と安全性の確認
薬物療法においては、個々の疾患に対して最大限の有効性と安全性が求められており、そのために、使用する薬物の体内動態(吸収・分布・代謝・排泄(はいせつ))を確認し(薬物動態学)、作用部位において薬物が疾患にどのように効果を発揮するかを評価すること(薬力学)が必要である。たとえば薬物動態学での確認で、体内への吸収が悪い、あるいは肝臓などで代謝されやすく本来有している効果が減弱する薬物は、内服薬としては不向きである。また、疾患治療として目的とする臓器・組織に到達(分布)しない薬物は、治療薬としては不適格といえる。
[北村正樹 2023年5月18日]
治療における薬物療法の位置づけ
現在、臨床現場における疾患治療においては、薬物療法のほかに手術などの外科療法、放射線療法、運動療法、食事療法など(非薬物療法)があり、疾患の種類によりこれらを単独または併用して治療が行われている。
一般的に各種疾患、とくに内科的疾患の治療では、薬物療法を中心に行う場合と薬物療法が補助的な位置づけとなる場合がある。薬物療法が中心となるおもな疾患としては、肺炎などの感染症があり、それに対応した各種抗菌薬が用いられている。抗菌薬を用いた薬物療法では、まず患者の炎症などの臨床症状(自覚および他覚症状)や血液などの臨床検査結果、あるいはX線などによる画像診断などから感染症の存在、感染病巣、さらには感染症の原因となっている病原微生物を特定した後に、該当する微生物に対しもっとも優れ、かつ感染病巣への薬剤移行性の高い抗菌薬を選択する必要がある。
一方、薬物療法が補助的な位置づけとなるおもな疾患としては、高血圧症や糖尿病などの、いわゆる生活習慣病があげられる。これらの疾患は日ごろの生活習慣(食事、運動、休養、喫煙、飲酒など)が発症要因の一つとされており、疾患の種類や重症度にもよるが、まずは食事療法や運動療法を基本として、効果不十分な場合に薬物療法が行われるのが一般的である。たとえば高血圧症は、食塩の過剰摂取、肥満、運動不足などが発症要因としてあげられていることから、これらを改善するために日ごろの食生活における減塩などの食事療法、有酸素運動などの運動療法が基本となり、それらが効果不十分な場合に降圧薬を用いた薬物療法が行われている。また、糖尿病には、膵臓(すいぞう)から分泌され糖代謝を調節しているインスリンの欠乏によって起こる1型糖尿病と、日本人の糖尿病患者の大部分を占めている2型糖尿病(なんらかの原因でインスリン分泌が減少して発症する)がある。1型糖尿病の治療ではインスリン製剤を用いた薬物療法が基本であるが、過食や運動不足、肥満などの生活習慣が関係している2型糖尿病では、食事療法や運動療法が基本となり、それらが効果不十分な場合に血糖降下薬やインスリン製剤などを用いた薬物療法が行われている。また、近年、増加傾向を示しているがん、とくに大腸がんなどの固形がんに関しては、摘出手術などの外科療法が第一選択となるが、補助的治療として放射線療法および薬物療法が施行されている。
[北村正樹 2023年5月18日]
知恵蔵 「薬物療法」の解説
薬物療法
(田中信市 東京国際大学教授 / 2007年)
出典 (株)朝日新聞出版発行「知恵蔵」知恵蔵について 情報
世界大百科事典(旧版)内の薬物療法の言及
【医療】より
…病気はそれらの調和が破れることから起こるので,熱性の病気には寒性の食物や薬品を与えるというふうにそれぞれ反対の性質のもので調和を図り,健康を回復させるという理論である。医療法には食事療法,薬物療法とあるが,食事療法を優先し,薬物使用はできるだけ避くべきものとしていた。また空気のよい所に病人を置くこと,運動と休養,衣服の材料の選択,睡眠と目覚め,男女の交わりの調節,精神状態の安定なども治癒のためたいせつな条件としていた。…
【医療】より
…病気はそれらの調和が破れることから起こるので,熱性の病気には寒性の食物や薬品を与えるというふうにそれぞれ反対の性質のもので調和を図り,健康を回復させるという理論である。医療法には食事療法,薬物療法とあるが,食事療法を優先し,薬物使用はできるだけ避くべきものとしていた。また空気のよい所に病人を置くこと,運動と休養,衣服の材料の選択,睡眠と目覚め,男女の交わりの調節,精神状態の安定なども治癒のためたいせつな条件としていた。…
【LSD】より
…体重1kgにつき1μgという微量でこの作用を示すことから,体内でLSDに似た物質が代謝異常によってつくられ,それが脳に働くとヒトの精神病がおきるのではないかという〈精神病の化学的原因説〉に根拠が与えられた。さらに,他の化学物質でそれを弱めることもできるはずだということから,52年に精神病の薬物療法が登場するきっかけとなった。LSDが脳内神経刺激伝達物質であるセロトニンの作用を抑えることがわかってから,LSD‐25の発見は精神薬理学の発達をも促し,脳研究を飛躍させるもとにもなった。…
※「薬物療法」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
お知らせ
4/12 日本大百科全書(ニッポニカ)を更新
4/12 デジタル大辞泉を更新
4/12 デジタル大辞泉プラスを更新
3/11 日本大百科全書(ニッポニカ)を更新
2/13 日本大百科全書(ニッポニカ)を更新



