内科学 第10版 「Cushing症候群」の解説
Cushing症候群(副腎皮質)
Cushing症候群はグルココルチコイドの慢性的過剰によって発症する全身性疾患であり,高血圧,中心性肥満,赤色皮膚線条,多毛などの身体的特徴を伴う.なおコルチゾール分泌過剰が下垂体ACTH産生腫瘍による場合はCushing病とよぶ.【⇨12-2-10)】
分類
機能的分類としてACTH依存性とACTH非依存性に大別され,病変部位を特定する手がかりとなる.臨床的分類として特徴的な身体所見を呈するCushing症候群と,その身体的所見を欠く症例とが存在する.後者はサブクリニカルCushing症候群と称され,副腎偶発腫を契機に見出されることが多い.
原因・病因
コルチゾール過剰の原因として下垂体のACTH産生腺腫(Cushing病),副腎皮質のコルチゾール産生腺腫,異所性ACTH産生腫瘍がある.その他,ACTH非依存性結節性副腎過形成(ACTH independent macronodular hyperplasia:AIMAH)によるCushing症候群がある.コルチコトロピン放出ホルモン(CRH)産生腫瘍で発症することもあるがきわめてまれである.グルココルチコイドの慢性的投与が原因となる場合もある(医原性Cushing症候群)(表12-6-3).
疫学・発生率
1997年に報告された厚生省の全国疫学調査ではCushing症候群のわが国における年間発生数は約1300例であり人口10万人に1人と推定される.内訳はコルチゾール産生副腎腺腫が47%,下垂体性Cushing症候群が36%,副腎結節過形成が6%,異所性ACTH産生腫瘍が4%程度でありコルチゾール産生副腎腺腫によるものが最も多い.好発年齢は40~50歳代であり,男女比は1:4で女性に多い.高血圧,糖尿病,肥満のすべてを有する患者では当然ながら発生頻度は高くなり5.6%との報告もある.腹部の画像検査で副腎腫瘍が偶然発見されることがあり副腎偶発腫と称されている.副腎偶発腫の約半数は臨床兆候を伴わない非機能性副腎腺腫である.わが国での副腎偶発腫3200余例の集計ではサブクリニカルCushing症候群を含めたコルチゾール産生腺腫は11.7%を占めており,ホルモン産生性副腎偶発腫瘍の中で最も多い.
病態生理
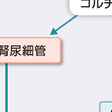
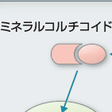
コルチゾールで代表されるグルココルチコイドは糖代謝,脂質代謝,蛋白異化,骨代謝に作用するステロイドである.コルチゾールは肝における糖新生酵素であるグルコース-6-リン酸化酵素およびホスホエノールピルビン酸カルボキシラーゼ(PEPCK)を活性化して肝からのグルコース放出を増加し血糖を上昇させる.さらに筋・脂肪など末梢組織では糖の取り込みと利用を抑制し,特に脂肪組織からは遊離脂肪酸が放出されインスリン抵抗性が高まる.Cushing症候群に特有の体型は脂肪の分布が変化することが原因であり末梢から体幹部,後頸部,上腕,肩にかけて皮下脂肪が再分布する.一方,コルチゾールは筋肉,結合組織,皮膚に対して異化作用を促進し,特にタイプ Ⅱの骨格筋の萎縮は近位部の筋力低下の原因となる.皮膚は菲薄化し皮下の結合組織は弱くなる結果,Cushing症候群に特徴的な皮膚線条が現れる.骨やカルシウム代謝に対しては骨塩量の低下,骨粗鬆症が生じるが,コルチゾールによる骨芽球の機能抑制がその原因と考えられる.また腸管からのカルシウムの吸収が抑制され腎尿細管からの排泄亢進によって生体内カルシウムは低下する. 高血圧はCushing症候群に特徴的ではないが高率に合併する主要な臨床所見である.原因としてコルチゾールの昇圧因子に対する血管反応性の増強作用や一酸化窒素(NO)やプロスタサイクリンなど血管拡張性因子の阻害作用が一因と考えられている(図12-6-11).腎におけるコルチゾールのナトリウム貯留作用はほとんど認められない.しかしCushing症候群ではデオキシコルチコステロン(DOC)やコルチコステロンなど中間代謝ステロイドが産生されている.これらのステロイドはアルドステロンに比しミネラルコルチコイド作用は弱いが慢性的な過剰により血圧は上昇する.異所性ACTH産生腫瘍によるCushing症候群のようにコルチゾールの産生量がきわめて多い場合にはコルチゾール不活性化酵素である2型11β-ヒドロキシステロイドデヒドロゲナーゼ(11β-HSD2)の作用が相対的に不足する結果,アルドステロン様の効果を生ずると考えられる.この病態はapparent mineralocorticoid excessとよばれる(図12-6-12). その他,コルチゾールには中枢神経系,免疫系,消化管,成長ホルモン系に対する作用があり,いずれもCushing症候群の臨床症状の原因となっている.免疫系ではリンパ球,特にT細胞を循環血中から網内系組織や骨髄に移行させると同時に好中球は増加し相対的リンパ球減少がみられる.コルチゾールは炎症性サイトカインを誘導するNFκBの核内移行を直接阻害することによって抗炎症作用を発揮する.グルココルチコイドは交感神経系に対してtyrosine hydrolaseやPNMT(phenylethanolamine N-methyl transferase)酵素活性を刺激してそれぞれノルアドレナリンとアドレナリン合成を促進する.
ステロイドは脂質溶解性であるので中枢神経系に容易に移行し気分や精神状態,食行動などに影響する.Cushing症候群ではうつ,多幸症など多彩な精神障害をきたすが,グルココルチコイド受容体は海馬や視床下部に多く分布しており固有の神経症状と関連しているものと推定される(表12-6-4).
臨床症状
1)自覚症状:
コルチゾール過剰は骨格筋線維を萎縮させる.自覚症状として起床時の立ち上がり,しゃがみ立ちや,階段の昇降時の脱力を自覚することが多い.コルチゾールのCa吸収抑制作用により成人では骨粗鬆症,小児では成長障害をきたす.骨密度は低下し腰椎の圧迫骨折,下腿骨の骨折が本症候群発見の契機となることもある.大腿骨骨頭骨折はステロイド過剰投与時に合併しやすい.前述した抑うつ気分,認知機能の低下,イライラ感などの精神神経症状もみられ,うつとして治療されていることもある.血液・免疫系細胞への影響から易感染性や治癒の遷延がみられる.高コルチゾール血症が著しい例では真菌症の皮膚や深部感染症を合併することがある.炎症症状はステロイドの作用により抑制されているので発熱,疼痛は顕著でない.その他,白内障,緑内障などによる視力障害も主訴となる.
異所性ACTH産生腫瘍では悪性腫瘍の進行が速くCushing症候群の症状が顕著化するまでに死亡するため,本患者では食欲不振ややせなど基礎疾患に伴う自覚症状が主体となることが多い.
2)他覚所見:
コルチゾールはほとんどの臓器に対して作用を有するため長期間コルチゾール過剰にさらされたCushing症候群では多彩な症候を呈する(表12-6-4).満月様顔貌,中心性肥満,後頸部の水牛様脂肪沈着,赤紫色の進展性皮膚線条,皮膚の毛細管の脆弱性,擦過,圧挫によるあざなどが特徴的身体所見であり,単純性肥満患者との鑑別点である(図12-6-13).コルチゾールはリポ蛋白リパーゼ活性を亢進し中性脂肪の取り込みを増加するので脂肪の再分布と沈着を生じる.脂肪の沈着は内臓にもみられ,糖代謝異常の原因となる.皮膚の萎縮は上皮細胞の増殖低下,線維芽細胞のコラーゲン合成低下によって生じ,その結果,皮下の血管が透見されやすくなり顔面紅潮,赤紫色の線条が出現する.多毛症は本症候群に特徴的所見であり,アンドロゲンの過剰による.高血圧や易血栓性の変化によりすでに脳血管障害を合併している例もある.
検査成績
高血圧,耐糖能異常,脂質異常症,低カリウム血症,白血球増加,好酸球減少,リンパ球減少,尿管結石,骨粗鬆症などが主要臨床所見である.単純性肥満との鑑別にはデキサメタゾンによる内因性コルチゾールの抑制を調べる.デキサメタゾン 1 mgを夜11時に服用させ翌日の朝に血漿コルチゾールが1 μg/dL以下に抑制されていればCushing症候群は否定される(デキサメタゾン簡易抑制試験).デキサメタゾン 2 mg(0.5 mg×4回/日)×2日間による低用量デキサメタゾン抑制試験でコルチゾールが抑制されない場合には,本症候群が疑われ,コルチゾール自律的産生の原因鑑別が必要となる.下垂体ACTHの依存性の有無は高用量デキサメタゾン(8 mg/日)の抑制試験により鑑別する.ACTH基礎値の低下(10 pg/mL以下),デキサメタゾン高用量非抑制,コルチゾール日内変動の消失(特に夜間の高値)は副腎性Cushing症候群の所見である.Cushing病では高用量のデキサメタゾンでコルチゾールは抑制され,ACTH,コルチゾールの日内変動は保持されていることから視床下部-下垂体系はコルチゾールのフィードバックに対して高い閾値にセットされていると推定される.異所性ACTH産生腫瘍によるCushing症候群では一般的にコルチゾールの産生量が多い.そのためコルチゾール不活性化が不十分となり前述したapparent mineralocortocoid excessを呈することがある.異所性ACTH産生腫瘍で著しい高血圧,代謝性アルカローシスや低カリウム血症などがみられた場合にはこの病態を疑うべきである.
診断
満月様顔貌(moon face),水牛様脂肪沈着(buffalo hump),中心性肥満(central obesity),痤瘡(acne),女性では多毛(hirsutism)などの身体所見に高血圧,糖尿病,骨粗鬆症,女性で尿路結石などが診断の契機となる.上述したコルチゾールの自律性分泌,デキサメタゾン抑制試験,尿中の遊離コルチゾールなどの内分泌検査によって確定診断し,下垂体および副腎の画像を参考に局在診断を行う.コルチゾール産生腫瘍はコレステロール含有量が多く腹部CT上,低吸収像を呈する(図12-6-14).
鑑別診断
単純性肥満でもコルチゾールは高値となるがデキサメタゾンの低用量によって抑制される.アルコール依存症では赤ら顔,満月様顔貌があり肥満や糖尿病,高血圧を合併する頻度が高い.アルコール依存症やうつ病でもコルチゾールは高値を示すが高用量デキサメタゾンで抑制される.女性における多毛症や月経不順,痤瘡は副腎のアンドロゲン産生副腎腺腫との鑑別を要する.
合併症
糖尿病,高血圧のほか骨折,重篤な感染(深部真菌症など),尿路結石を合併することがある.Cushing症候群は放置すれば心血管障害を合併し致命的である.骨折,抑うつなどQOLにも大きく影響する.
治療
Cushing症候群の治療は,コルチゾール過剰の原因診断を確定し,その原因と病態に即して治療法を選択するのが原則である.すなわち下垂体腺腫では経蝶形骨洞的下垂体腺腫摘出術(Hardy法)を行う.異所性ACTH産生腫瘍では基礎疾患の治療,副腎性Cushing症候群では腺腫の摘出である.外科手術の不可能な場合には薬物療法が適応となる.
1)外科的治療:
わが国におけるCushing症候群の疫学調査では,副腎腺腫例の98%において外科的治療が施行されている.今日,腹腔鏡下副腎摘除術(一部の施設では腺腫摘除術)が広く行われている.副腎腺腫による本症候群では,対側副腎のコルチゾール産生能は抑制されているため,術後はグルココルチコイドの補充が必要となる.対側副腎の機能が完全に回復し補充が不要となるまで数カ月ないし,ときに1〜2年を要する.副腎腺腫と診断し,切除した症例のなかに,まれに副腎癌が存在する.副腎癌はわが国の集計では本症候群の約5%である.組織学的に両者を鑑別するのは困難なことが多い.画像上や手術所見で周辺組織に浸潤が疑われる場合には,術後の再発,転移などに留意し,定期的に観察を行う.
2)薬物療法:
外科的治療により完治が得られない症例,悪性腫瘍による異所性ACTH産生,高コルチゾール血症による著しい精神神経症状,術前や放射線照射が奏効するまでの期間にコルチゾール分泌を抑制する目的で,薬物療法が行われる.今日,臨床的に使用されている薬剤には,ACTH分泌抑制剤としてサイクロヘプタゾン,プロモクリプチンなどがある.コルチゾール産生を阻害するためにメチラポン,ミトタンなどのステロイド合成酵素阻害薬が有効である.薬物療法中は副腎ステロイドの産生が正常以下に抑制される可能性があるので,随時,血中コルチゾールの測定を行い正常範囲に維持されていることを確定する.[宮森 勇]
出典 内科学 第10版内科学 第10版について 情報