精選版 日本国語大辞典 「タリウム」の意味・読み・例文・類語
タリウム
出典 精選版 日本国語大辞典精選版 日本国語大辞典について 情報
化学辞典 第2版 「タリウム」の解説
タリウム
タリウム
thallium
Tl.原子番号81の元素.電子配置[Xe]4f 145d106s26p1の周期表13族元素.1861年W. Crookes(クルックス)が硫酸合成工場の残さ中に発見した.原子スペクトル中の美しい緑色の輝線にちなみ,“緑の若芽”を意味するギリシア語のθαλλο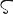 (thallos)から命名された.原子量204.3833(2).質量数203(29.524(1)%),205(70.48(1)%)の2種の安定同位体と,質量数176~212の放射性同位体が知られている.
(thallos)から命名された.原子量204.3833(2).質量数203(29.524(1)%),205(70.48(1)%)の2種の安定同位体と,質量数176~212の放射性同位体が知られている.
地殻中の存在度0.36 ppm.K+ と同型置換するためカリ長石,雲母などに広く薄く分布するが,親銅元素で,銅,亜鉛,鉛などの硫化鉱物中に伴われて産出するので,これら金属の精錬の際に煙道じんまたは残さから副産物として得られる.硫酸塩飽和水溶液の電解により金属がつくられる.希少鉱物としてTlAsS2(ローランダイト),(Cu,Tl,Ag)2Se(クルックス石)などがある.α(六方最密),230 ℃ 以上でβ(体心立方)の2変態が知られる.鉛に似た軟らかい白色の金属.融点304 ℃,沸点1457 ℃.密度11.85 g cm-3(20 ℃).金属は硫酸,硝酸には可溶,塩酸には溶けない.酸化数1,3.第一イオン化エネルギー6.108 eV.TlⅠは,アルカリ金属および銀に似ており,水酸化物TlOHはかなり強い塩基で,ハロゲン化物は感光性があり,フッ化物以外は水に難溶である.空気中で容易に酸化されて黒色のTl2Oを生じ,Tl2Oは水と接触して黄色のTlOHとなる.標準電極電位 Tl+/Tl-0.3363 V,Tl3+/Tl++1.25 V.したがって TlⅢは容易に TlⅠに還元されるが,TlⅠを TlⅢに酸化するにはMnⅦ O4-,Cl2 のような強力な酸化剤が必要である.Tlの原子価殻は6s26p1で6p電子は容易に失われるか,結合にあずかれるが,6s2は安定で TlⅢにはなりにくいので,タリウム(Ⅰ)化合物のほうが多く知られる.TlⅠClを水懸濁液やアセトニトリル溶液中で,Cl2 で酸化するとTlⅢ Cl3が得られる.TlⅢは同族の AlⅢなどと異なりHSAB原理による軟酸にあたるので,R-(R = アルキル)など軟塩基と錯体をつくりやすい.R3TlⅢ(R = メチル,エチル,イソブチルなど)が知られている.TlⅢ Cl3も [TlⅢCl4]- となりやすく,錯化合物のほうが安定である.
タリウムはKの関与する生理作用を阻害するため,神経系,肺,肝臓,腎臓などに対する毒性が強く(致死量1 g),カドミウムより4けたも危険とされる.PRTR(環境汚染物質排出移動登録)法・第二種化学物質として,経口クラス2,作業環境クラス2,生態クラス1の指定を受けている(1がもっとも厳しい).従来の用途は,殺鼠剤,殺虫剤,顔料木材防腐剤などであったが,人体に対する毒性のために使用量が減った.放射線測定用シンチレーションカウンター用のシンチレーター賦活剤として,レーザー発振用タリウム系Ⅲ-Ⅴ族半導体,光電管,水銀との合金は低温(-60 ℃ まで)でもはたらく電流開閉器に,酸化タリウムは高屈折率ガラス(光ファイバー用)などとして使われる.転移温度95~128 K のTl,Ba,Caを含む一連の酸化銅系高温超伝導体が知られ,Ba2CaCu2Tl2O8薄膜は携帯電話基地局受信用マイクロ波フィルターとして実用化されている.(Hg0.8Tl0.2)Ba2Ca2Cu3O8.33は定比化合物最高の転移温度138 K を示す.[CAS 7440-28-0]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
改訂新版 世界大百科事典 「タリウム」の意味・わかりやすい解説
タリウム
thallium
周期表第ⅢB族に属する金属元素。1861年W.クルックスが硫酸工場の鉛室泥からスペクトル分析法により発見した。スペクトル中に特有の緑色線が現れることから,ギリシア語thallos(〈緑の若枝〉の意)にちなんで命名された。おもに硫化鉱物中に見いだされ,広範囲に分布しているが,いずれもきわめて低濃度にしか存在しない。花コウ岩や雲母などカリウムの多い鉱物中にはルビジウムに伴って存在する。これはともに1価イオンでイオン半径が似ているためである。工業生産用の原料はセン亜鉛鉱や硫化鉛等の硫化鉱物製錬のさいに生ずる煙灰,陽極泥や硫化鉱を用いる鉛室法硫酸の鉛室泥である。これらを硫酸で溶かし,塩酸を加えて水に難溶な塩化タリウムとして沈殿分離し,最後に硫酸溶液から電解精製する。白色光沢の金属だが空気中ですぐに灰色となる。鉛より軟らかく,手でも成形できる。常温では最密充てん六方晶系,230℃で体心立方正方晶系,高圧では面心立方正方晶系と3態をとり,3重点は110℃,3×104気圧である。湿った空気中では酸化されやすく,厚い皮膜となるので,石油中に保存する。空気中で100℃に加熱すると褐色の酸化タリウム(Ⅲ)Tl2O3を生じ,また常温でもオゾン,過酸化水素によりTl2O3を生ずる。希硝酸によく溶ける。タリウムは,1価の化合物のなかでTlOHが強塩基という点でアルカリ金属に,フッ化物を除くハロゲン化物が難水溶性という点で銀または鉛に似ている。3価のタリウム化合物は1価に還元されやすく,したがってかなり強い酸化剤である。また錯体をつくって安定化する傾向が大きい。タリウム化合物,とくに1価の化合物は毒性が強く,その症状はやや鉛毒に似る。硫酸タリウム(Ⅰ)Tl2SO4は無味無臭で,人間に対する致死量は1.75gである。一度体内に摂取すると排出速度が遅く(1日に3.2%),消化管,神経系に障害を与え,慢性中毒症状としては,脱力感,手足の痛み,脱毛がある。急性症状としては,吐き気,下痢,手足の痛み,昏睡,痙攣(けいれん)などがあり,呼吸器,循環器の障害により死に至る。食物に混ぜて殺鼠(さつそ)剤として古くから用いられている。ハロゲン化物は赤外線をよく通し,赤外通信用の窓材料に使われ,そのほかシンチレーション用,電子材料として用途が広がっている。
執筆者:水町 邦彦
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「タリウム」の意味・わかりやすい解説
タリウム
たりうむ
thallium
周期表第13族に属し、アルミニウム族元素の一つ。1861年イギリスのクルックスが硫酸製造工場の鉛室残渣(ざんさ)から分光分析によって発見、そのスペクトルが美しい緑の輝線を示すことから、緑の小枝を意味するラテン語thallusにちなんで命名された。いくつかの鉱石があるが、銅、鉛、亜鉛などの硫化鉱の焙焼(ばいしょう)煙灰がおもな原料であって、水で抽出し、不純物を除いてから塩化タリウム(Ⅰ)として沈殿させる。これを酸性溶液から亜鉛で還元すると金属が得られる。鉛に似た軟らかい白色金属。2種類の変態が知られているが、常温ではα(アルファ)型が安定、230℃に熱すると体心立方格子のβ(ベータ)型に転移する。空気中では酸化されるので、普通、石油の中に入れて保存する。ハロゲン化水素酸には溶けないが、通常の酸には溶ける。酸化数ⅠとⅢの化合物をつくるが、前者のほうが安定である。酸化数Ⅱの化合物のように見える、たとえばTlCl2は実際はTlI[TlIIICl4]のような混合酸化数の化合物である。ハロゲン化物は銀塩と同じく水に不溶だが、水酸化物はアルカリ金属塩と同じく水に溶けて強アルカリとなる。硫化物は赤外光電池、炭酸塩はガラス添加物として使われ、臭化物、ヨウ化物は蛍光物質添加物、赤外線透過用の光学材料となる。ギ酸タリウムは放射線遮蔽(しゃへい)剤として用いられる。硫酸塩は殺鼠剤(さっそざい)として使われたことがあるが、現在は使用を禁止している国が多い。タリウムおよびタリウム化合物は毒性が強く、蓄積性毒物である。
[守永健一・中原勝儼]
ブリタニカ国際大百科事典 小項目事典 「タリウム」の意味・わかりやすい解説
タリウム
thallium
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「タリウム」の意味・わかりやすい解説
タリウム
→関連項目核医学的検査
出典 株式会社平凡社百科事典マイペディアについて 情報
世界大百科事典(旧版)内のタリウムの言及
【クルックス】より
…ロンドンにある王立化学大学を卒業後,有機化学者A.W.ホフマンの助手となったが,有機化学には興味がもてず1854年に辞し,56年から自宅の実験室を用いて化学コンサルタントとなり,59年からは《ケミカルニュース》の編集者にもなった。60年に発表されたR.W.ブンゼンとG.R.キルヒホフらによる分光分析に注目し,61年には新金属元素タリウムを発見し,この功績によりローヤル・ソサエティの会員に選ばれた。またタリウムの重量分析用真空てんびんを製作する中でラジオメーター(放射計)を発明し(1875),羽根の回転の原因を気体分子運動論より説明した。…
※「タリウム」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
お知らせ
4/12 日本大百科全書(ニッポニカ)を更新
4/12 デジタル大辞泉を更新
4/12 デジタル大辞泉プラスを更新
3/11 日本大百科全書(ニッポニカ)を更新
2/13 日本大百科全書(ニッポニカ)を更新


