化学辞典 第2版 「化学緩和法」の解説
化学緩和法
カガクカンワホウ
chemical relaxation method
1950年代にM. Eigen(アイゲン)らによって考案された,水溶液中のイオン反応の速度定数を測定するのに用いられた方法.イオンの中和反応や配位子交換反応などの速い反応の速度定数の測定には,ラピッドフロー法(溶液の混合に 10-3 s 程度の時間を要する)などは使えない.Eigenらは平衡にある反応系に瞬間的な温度や圧力の摂動を与え,新しい平衡値への緩和時間を光吸収や電気抵抗の変化などによって測定して速度定数を決定した.水溶液の加熱にはコンデンサーの放電によるジュール熱が使われるが,小さな反応系が熱平衡に達するのは 10-9 s 程度である.この方法を温度ジャンプ法という.与えられる温度変化や圧力変化が小さいため,緩和はどのような平衡反応でも一次になる.たとえば,次のような可逆反応では,
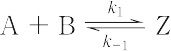
Aの濃度を a0 - x,Bの濃度を b0 - x,Zの濃度をxとすると,濃度の時間変化はつねに次式で表される.
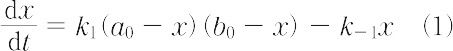
いま,平衡値 xe からのずれをΔx = x - xe とする.すると次式が成立する.
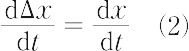
k1(a0 - xe)(b0 - xe) = k-1xe (3)
(3)は平衡での釣合いを示す.これらを展開して整理すれば次式が得られる.
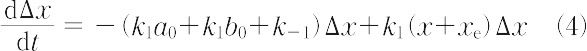
平衡からのずれは大きくないからx ≈ xe,x + xe = 2xeとおいて次式になる.
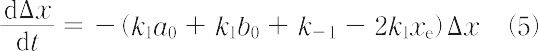
これを時間について積分する.
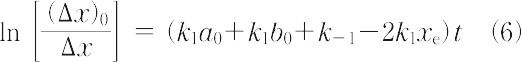
(Δx)0 は初期値である.こうして,緩和時間として次式が得られる.
τ = (k1a0 + k1b0 + k-1 - 2k1xe)-1
= [k1(ae + be) + k-1]-1 (7)
ここで,ae と be は平衡におけるAとBの濃度である.そこで,ae + be のいろいろな濃度で緩和時間τを測れば,k1/k-1 が平衡定数であることを利用して,k1 および k-1 を求めることができる.Eigen(アイゲン)らはこの方法を使って,23 ℃ におけるH3O+とOH-の中和反応の速度定数が1.4×1011 dm mol-1 s-1 であることを導いている.これらの先駆的な研究により,Eigenは1967年にノーベル化学賞を贈られた.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
