日本大百科全書(ニッポニカ) 「イオン(原子)」の意味・わかりやすい解説
イオン(原子)
いおん
ion
原子あるいは原子団において、それを構成する全原子核のもつ正電荷数と、全電子(電子の記号はe-)のもつ負電荷数とが同じでないものをイオンという。
[岩本振武]
イオンの発見
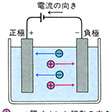
電解質、たとえば塩化ナトリウムNaClの水溶液に直流電流を通じると、低電位極(負極、陰極cathode)へ向かってナトリウムの原子が移動し、高電位極(正極、陽極anode)に向かって塩素の原子が移動する。この現象をイギリスのファラデーは、ナトリウムの原子が正の電荷をもち、塩素の原子が負の電荷をもっているためと説明し、これらの電荷をもつ原子を「移動する」という意味のギリシア語ionaiからイオンionと命名した。その後、電子の存在や原子の電子構造などの研究が進み、イオンとは中性原子あるいは原子団における整数個の電子の得失によって生ずるものであることが明らかにされた。
[岩本振武]
陽イオンと陰イオン
正電荷数が過剰のもの、すなわち中性の原子または原子団から電子が失われたものを陽イオン(カチオンcation)といい、負電荷数が過剰のもの、すなわち中性の原子または原子団に電子が加わったものを陰イオン(アニオンanion)という。陽イオンは正イオン、陰イオンは負イオンとよぶこともある。
[岩本振武]
両性イオン
中性の分子であっても、陽イオン部分と陰イオン部分を含む構造をもつものがあり、これを両性イオンという。アミノ酸はその分子中にアミノ基-NH2とカルボキシ基-COOHとをもつが、水溶液中や結晶中で両性イオンとなりやすいことが知られている。
NH2-R-COOH→NH3+-R-COO-
[岩本振武]
イオン記号、イオン価
イオンは、そのもととなる原子あるいは原子団の化学記号の右肩に、得失した電子の個数を符号とともに示した記号であるイオン記号で表される。得失した電子の個数はイオン価であり、一般に正n価の陽イオンはMn+とし、負n価の陰イオンをXn-のように示す。n+のかわりに+nを、n-のかわりに-nを用いたり、+や-を価数だけ列記すること(Fe+++、SO4--)もあるが、現在では正式の表記法ではない。イオン1個のもつ電気量は電子1個のもつ電気量の絶対値(電気素量)のイオン価倍になる。
[岩本振武]
イオン化
原子、分子、あるいは原子団が1個以上の電子を失うか、得るかしてイオンになることをイオン化または電離という。陽イオン化に必要なエネルギーをイオン化エネルギー、陰イオン化に際して放出されるエネルギーを電子親和力という。
γ(ガンマ)線、X線、紫外線などの高エネルギー電磁波や、電子を高電圧で加速した電子線を照射したり、高温度に加熱して熱エネルギーを供給すると、原子や分子がイオン化される。地球の高層大気には、太陽からの紫外線、X線および宇宙線によって生ずると考えられるイオン層(電離層)が数層あって、その電荷密度や層構造は昼夜間、日食などによる太陽の影響を大きく受けている。ガイガー‐ミュラー計数管や霧箱(きりばこ)は、放射線によるイオン化を利用した気体電離型の放射能測定装置である。
化学反応によるイオン化は酸化還元反応であり、たとえば2種の単体が反応する際、一方が陽イオン化すれば他方は陰イオン化し、陽イオン化する物質から陰イオン化する物質へ電子が移動する。
[岩本振武]
溶液中のイオン
水その他の電離性溶媒に溶けて陰・陽両イオンを与える物質を電解質という。電離性溶媒の分子は一般に極性分子であり、それ自身電離平衡によって陽イオンと陰イオンに解離する。
水やアンモニアのように電離の際に水素イオン(プロトン。重水素イオンも含めた厳密な表記では、ヒドロン)の移動を伴う溶媒はプロトン性溶媒であり、二酸化硫黄のようにプロトンを含まない溶媒は非プロトン性溶媒である。これらの溶媒の電離平衡定数は一般にきわめて小さく、水の場合でも25℃で
[H3O+][OH-]=10-14mol2dm-6
程度である。
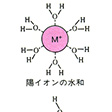
電解質が水に溶けると、陽イオンの周りには電気的に負な酸素原子が配向して水分子が集まり、水和構造をつくる。陰イオンの周りには電気的に正の水素原子が配向して水分子が引き付けられる。陽イオンと陰イオンが静電引力で凝集したイオン結晶が水に溶けるのは、結晶を形成しているよりも、各イオンが水和構造をつくって分散するほうがエネルギー的に安定になるからである。もし水和したほうが不安定になるならば、その結晶は水に溶けにくくなる。
電解質はかならずしもイオン結晶だけとは限らず、たとえば塩化水素HClは共有結合性分子であるが、水に溶けると電離して塩酸となる。
HCl+H2O→H3O++Cl-
塩酸中にはHCl分子はほとんど存在せず、電離はほぼ100%進行する。このような物質は強電解質であり、電離度の小さい物質は弱電解質である。
電解質が水に溶けたときに水分子と化学反応をおこすことがある。酸化物イオンO2-は固体中や融解塩中には存在するが、水に溶けると水酸化物イオンになる。
O2-+H2O→2OH-
水素イオンH+も単独には存在せず、一般にH(H2O)n+として数個の水分子と水和した状態になっている。これをオキソニウムイオンといい、nは4以上と考えられているが、一般にはH3O+の記号で表している。
陽イオンは、中性原子から電子が失われたものであるから、残っている電子はますます強く原子核に引き付けられ、イオン半径が小さくなって正の電荷密度も大きくなる。そのため、水分子の酸素原子は多価陽イオンに強く引き付けられ、水分子内の電子も酸素原子側に移動して、水素原子はより陽イオン的となる。その結果、水素原子は陽イオンとなって放出され、多価陽イオン全体の正電荷を見かけ上減少させようとする。これは加水分解の一種であり、Al3+、Fe3+、Ti4+、V5+などの陽イオンはとくに加水分解を受けやすい。チタン(Ⅳ)やバナジウム(Ⅴ)などの陽イオンは単独では水溶液中に存在できず、オキシドチタン(Ⅳ)イオン(チタニルイオン)TiO2+やジオキシドバナジウム(Ⅴ)イオン(バナジルイオン)VO2+などのオキソイオンとなる。クロム(Ⅵ)やマンガン(Ⅶ)などのように大きなイオン価をもつイオンになると、陽イオンとしてではなく、クロム酸イオンCrO42-や過マンガン酸イオンMnO4-などのような陰イオン、オキソ酸イオンになって存在している。
水和水は溶媒の水と絶えず交換されているが、その交換速度は陽イオンの電荷密度が高くなるにつれて遅くなる。強く水和した陽イオンは、水分子を配位子とする錯イオンと考えられる。d軌道電子が9個以下の遷移元素のイオンが水溶液中で示す特有の色は、水を配位子とする錯イオンの色である。銅(Ⅱ)の硝酸塩や硫酸塩の水溶液は青色を呈するが、これはテトラアクア銅(Ⅱ)イオン[Cu(H2O)4]2+の色である。水よりも強い配位能力をもつ配位子を加えると、配位水和水との置換がおきて新しい錯イオンが生成する。たとえば、銅(Ⅱ)塩の水溶液にアンモニア水を加えると、テトラアンミン銅(Ⅱ)イオン[Cu(NH3)4]2+が生じて、溶液は青紫色となる。
[岩本振武]
多原子イオンの構造
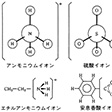
アンモニア分子に水素イオンが付加するとアンモニウムイオンを生ずる。
NH3+H+→NH4+
しかしその構造はメタンCH4と同じ正四面体型となり、4個の水素原子の中のどれがH+であるかの区別はできない。NH4原子団が全体として+1価の陽イオンになっているのである。同様に硫酸H2SO4(=SO2(OH)2)から生ずる硫酸イオンSO42-においても、その構造は正四面体型であり、4個の酸素原子は等価である。一方、アルキルアミンやカルボン酸のような有機電解質では、それぞれの官能基だけがイオン化していると考えたほうがよく、分子全体に均等な電荷分布があるわけではない。
[岩本振武]
『ロナルド・W・ガーネイ著、鈴木伸訳『イオン溶液論』(1966・産業図書)』