化学辞典 第2版 「アレニウス式」の解説
アレニウス式
アレニウスシキ
Arrhenius' equation
反応速度定数の温度依存性を表す実験式で,1889年,S.A. Arrhenius(アレニウス)により提出された.反応速度定数kは絶対温度Tの関数として,
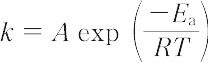
と表せる.ここで,Rは気体定数,Aおよび Ea は反応に特有の定数で,Aは頻度因子,Ea は見掛けの活性化エネルギーとよばれる.Aおよび Ea は厳密には温度とともにわずかに変化するが,狭い温度範囲では温度に無関係な定数とみなせる.この式ははじめ,水溶液中のショ糖の転化反応の速度について求められたものであるが,一部の高速反応を除いて,広く各種の化学反応にあてはまる.kが一つの素反応に対応する場合には,アレニウス式の各定数は絶対反応速度論により物理的意味が明確にされているが,いくつかの素反応の集積された複合反応の速度定数である場合には,その物理的意味は複雑であり,単に実験式の定数にすぎない場合も多い([別用語参照]遷移状態理論).実験的には,反応速度式の成立する温度範囲と,各温度でのkの値が求まれば,アレニウスプロットとよばれるlog kと1/Tのプロットにより直線が得られ,その勾配より
Ea,1/T→0
に外挿した点のlog kの値からAが求まる.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
