反応速度(読み)ハンノウソクド(英語表記)reaction rate
精選版 日本国語大辞典 「反応速度」の意味・読み・例文・類語
はんのう‐そくど ハンオウ‥【反応速度】
出典 精選版 日本国語大辞典精選版 日本国語大辞典について 情報
改訂新版 世界大百科事典 「反応速度」の意味・わかりやすい解説
反応速度 (はんのうそくど)
reaction rate
reaction velocity
化学反応が進む速度。反応速度は反応の種類によってさまざまである。爆発は迅速に進む反応によって起こるのに対し,腐食は一般にかなり遅い反応である。反応速度は,一般に反応により変化する物質の時間的変化率で表される。反応速度を調べることは,実際上必要であるばかりでなく,化学反応の仕組みを解明するためにも重要であり,とくに反応速度を取り扱う学問分野に反応速度論chemical kineticsあるいは化学動力学がある。反応速度が系統的に調べはじめられたのは比較的新しく,19世紀中ごろになってからである。1850年,ドイツの化学者ウィルヘルミーLudwig Ferdinand Wilhelmy(1812-64)は,酸を触媒とするショ糖の加水分解反応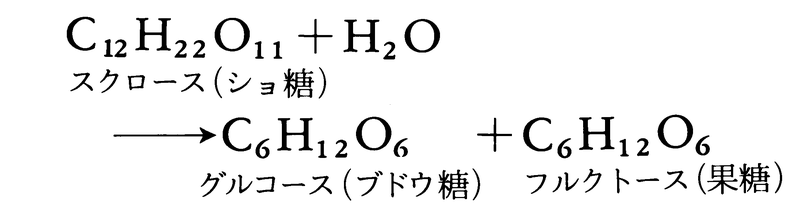
を研究し,反応が進むと旋光性が右旋性から左旋性に変わることを利用して,この反応速度を測定し,温度,酸濃度などの条件を一定とすれば,反応速度はショ糖の濃度に比例することを見いだした。続いて62年には,フランスの化学者P.E.M.ベルトロとサンジルLéon Péan de Saint-Gilles(1832-63)は,酢酸エチルの生成と分解の反応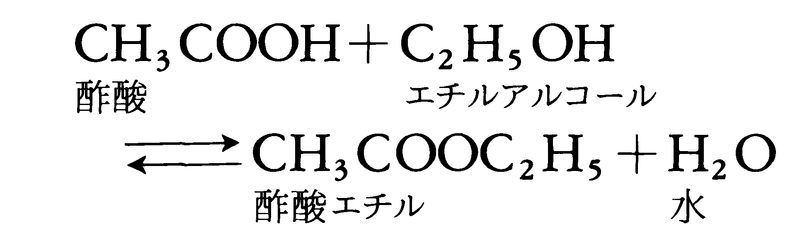
を詳細に調べ,上式で右向きの酢酸エチルの生成反応の速度vは,酢酸とエチルアルコールのそれぞれの濃度に比例し,左向きの酢酸エチルの分解反応の速度v′は,酢酸エチルの濃度に比例し,それぞれ,
v=k[CH3COOH][C2H5OH] ……(1)
v′=k′[CH3COOC2H5] ……(2)
で与えられることを見いだした。ここで[ ]は濃度を表す。64年,ノルウェーのC.M.グルベルグとP.ボーゲは,反応する物質間に働く親和力はそれが作用する範囲にある物質の量に比例すると考え,これらの反応速度の式を説明した。酢酸エチルの生成と分解の反応が釣合いの状態に達したとき,前記の反応式の右向きと左向きの反応速度は等しく,v=v′となるであろう。このとき,反応に関与する各物質の平衡濃度の間に次の関係が成り立つはずである。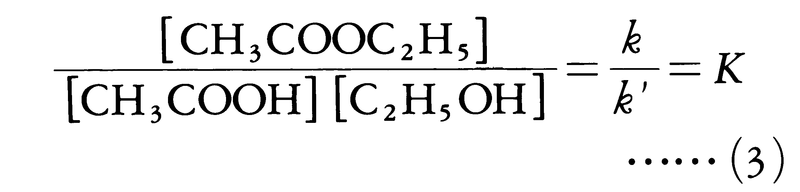
この関係を質量作用の法則という。
反応速度式
一般に,次の化学反応式
aA+bB+……⇄mM+nN+……
で与えられる化学反応の右向きの反応速度vは,多くの場合,
の形に表される。一般にa′はaに,b′はbに一致せず,上に示した酢酸エチルの生成・分解反応のように,a=a′,b=b′の関係がつねに成り立つわけではない。このことは,一般に用いられる化学反応式は反応前後の反応物と生成物の量的関係を総括的に与えるもので,反応が実際に起こる道すじを示しているわけではないためである。一般に化学反応が進む道すじは通常の化学反応式が示すように単純ではなく,非常に複雑な道すじを通ることが多い。式(4)のように,反応速度と反応に関与する物質の濃度との関係を与える式を反応速度式という。kは温度,圧力に依存するが,濃度には依存しない定数で,反応速度定数または単に速度定数と呼ばれる。反応の進む道すじがわかっているとき,反応速度式を理論的に導くことができるが,一般にはまず実験的に反応速度式を定め,これから反応が進む機構を推定することが多い。
式(4)の形の反応速度式で,べき指数a′,b′,……を反応次数order of reactionといい,a′,b′,……のどれか一つが1で他はすべて0のとき,一次反応first-order reactionと呼び,反応速度は濃度の一次関数となる。またa′,b′,……が0または正の整数で,a′+b′+……=2のとき二次反応という。一次反応,二次反応の例は非常に多いが,a′+b′+……=3となる三次反応の例は少なく,
2NO+Br2─→2NOBr
2FeCl3+SnCl2─→2FeCl2+SnCl4
などが知られている。三次以上の速度式を与える例はほとんど知られていない。反応速度式から非常に高次のようにみえる反応でも,低次の速度式を与える場合が多く,たとえば,
KClO3+6FeSO4+3H2SO4─→KCl+3Fe2(SO4)3+3H2O
は二次反応であり,
6FeCl2+KClO3+6HCl─→6FeCl3+KCl+3H2O
は三次反応である。触媒反応や不均一相の反応では,式(4)よりさらに複雑な形の反応速度式を与える場合がある。
衝突理論
反応速度は濃度ばかりでなく,温度によっても著しい影響をうける。一般に温度が高いほど反応速度は速くなり,速度定数kの対数と絶対温度の逆数1/Tとの間によい直線関係が成り立つ。この関係は,1889年にスウェーデンの物理化学者S.A.アレニウスにより提出されたもので,式で表すと
k=Aexp(-Ea/RT) ……(5)
となる。この式でAとEaは反応の種類によって定まる定数,Rは気体定数である(アレニウスの式)。アレニウスは,この結果を,反応はある一定値以上のエネルギーをもつ分子によってひき起こされ,そのような分子の数は温度が高くなるとともに増大するためと考えた。すなわち,反応が起こるためにはある大きさ以上のエネルギーが必要であり,これを活性化エネルギーと呼ぶ。式(5)のEaが活性化エネルギーに相当する。この結果は,化学反応が分子間の衝突によって起こると考えることによってうまく説明することができる。たとえばAとBの反応で,活性化エネルギーEa以上のエネルギーをもつAの活性分子A*とBとの間の衝突によって化学反応が起こるとすれば,反応速度は,
v=ZNA*NB=Zexp(-Ea/RT)NANB ……(6)
となる。NA,NBはそれぞれA,Bの分子数で,活性分子A*の分子数NA*は,
NA*=NAexp(-Ea/RT)
で与えられるからである。Zは単位時間当りの1個の分子の衝突数である。式(6)から速度定数は,
k=Zexp(-Ea/RT)
となり,これは式(5)と同じ形である。式(5)の定数Aは衝突数に相当し,頻度因子と呼ばれる。衝突数Zは通常の条件で4×1010~4×1011l/mol・sの範囲にあり,式(6)は比較的簡単な分子の反応に対してよく成り立つことが,実際に確かめられている。しかし複雑な分子の反応では必ずしも成り立たない。それは,活性分子が衝突すれば必ず反応が起こるわけではなく,衝突の方向によっては起こらないこともあるためである。そこで反応に有効な衝突数をpZで表すと,速度定数kは,
k=pZexp(-Ea/RT) ……(7)
で与えられることになる。pは反応に有効な衝突の割合で,立体因子と呼ばれる。これが衝突理論による速度定数の一般式である。
衝突理論は気相での反応をよく説明する。しかし,もし気相における反応が分子間の衝突を経て起こるのであれば,最も簡単な反応は2分子の衝突に基づく二次反応であり,一次反応は光を吸収して活性化された分子が分解する反応などを除いて考えにくい。実際には,五酸化二窒素の熱分解反応(2N2O5─→2N2O4+O2)のように,気相でも一次反応は確かに起こる。イギリスのリンデマンFrederick Alexander Lindemannは,衝突理論に基づいて一次反応の機構を正しく解釈した。反応物分子AはAどうしの衝突により活性化され,活性分子A*になる。活性分子A*がある程度の安定性をもてば,それはゆっくり化学結合の組替えを起こして生成物に変化するが,このとき活性分子が活性化エネルギーを失い不活性化し,通常の分子にもどる過程もかなりの速度で起こり,活性化と不活性化の過程はほぼ平衡の状態にある。このとき活性分子の濃度[A*]は通常分子の濃度[A]に比例し,一次反応となる。この事情は次のように反応機構を書くとはっきりする。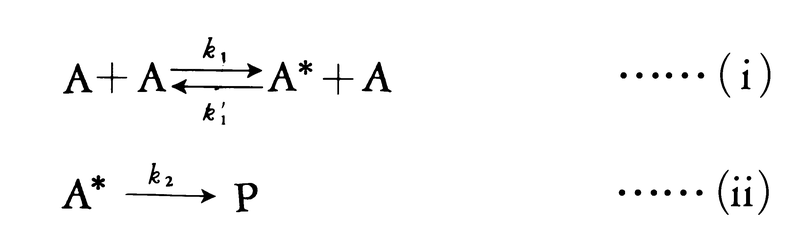
第1の反応段階はほぼ平衡の状態にあるから,k1[A]2=k1′[A*][A]の関係が成り立ち,活性分子A*の濃度は,[A*]=(k1/k1′)[A]となることがわかる。反応速度は生成物Pの生成速度で与えられるので,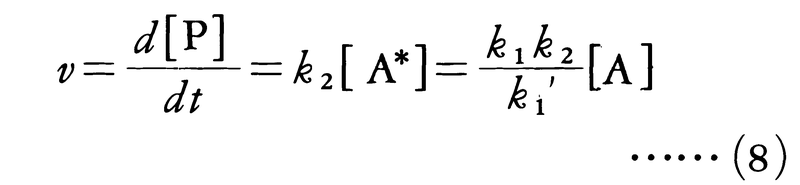
となり,Aについて一次反応となる。反応物の濃度が非常に低くなると,この反応の次数が一次より大きくなって二次に近づくことは,この反応機構の正しさを示している。すなわち,[A]が非常に小さくなると,衝突頻度が小さくなり,活性分子が不活性化する過程が起こりにくくなる。このとき第1段階(i)の逆反応の寄与は無視され,反応速度は活性分子の生成速度に等しく,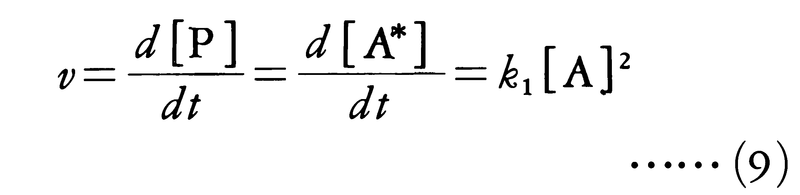
となり,Aについて二次反応となる。この結果は衝突理論が反応機構を理解するために有用であることを示すとともに,一次反応のように見かけ上簡単な反応でも,実際に反応が進む経路はかなり複雑であることを示している。
反応速度の測定
比較的遅い反応,すなわち半減期(反応物の濃度が初濃度の半分にまで減少する時間)が数分以上であれば,滴定などの分析方法によって,反応物あるいは生成物の濃度の時間的変化を測定し,反応速度を決定できる。分析には測定操作が簡便で迅速な可視紫外吸収スペクトルや赤外吸収スペクトルのほか,ガスクロマトグラフや液体クロマトグラフの方法も広く用いられている。半減期が数分以下の速い反応の速度を測定するためには特別のくふうが必要となる。高速反応の速度を測定する代表的な方法として流通法と緩和法があるが,これらは比較的最近開発されたものであり,これにより反応速度に関する知見は非常に豊富になった。流通法は,速い反応速度の測定に適するように特別に設計された反応装置を用い,2種の反応液を一定の高速度で装置内を流すことにより急速に混合する。混合された反応液は反応を起こしながら,反応管の中を一定速度で流れる。そこで反応管の各点での成分の濃度をスペクトルなどの迅速な方法で測定することにより,混合直後の反応物あるいは生成物の濃度の時間変化を追跡することができる。流通法の変形にストップドフロー法がある。これは2種の反応液をピストンを用いて反応器中に急速に混合し,反応器中の反応物あるいは生成物の濃度の時間変化をスペクトル的に追跡する方法である。これらの方法によって,半減期が数分から数msの反応速度を測定することができる。より高速の反応に対しては緩和法が用いられる。これはドイツのM.アイゲンにより開発された方法で,その測定原理は,平衡状態にある反応系の温度あるいは圧力を急速に変化させることにより,非平衡状態とし,系が新しい平衡状態に接近する過程を測定し,反応速度を決定しようとするものである。この方法は温度ジャンプ法,圧力ジャンプ法などとも呼ばれ,これらの方法により半減期が1~10⁻6秒の反応速度を測定することができる。緩和法により,水中での酸と塩基の中和反応
H3O⁺+OH⁻─→2H2O
の反応速度が初めて測定された。速度定数は25℃で,k=1.4×1011l/mol・sである。この値は水溶液中の二次反応速度としてこれまで実測されたもののうち最大のもので,10⁻3molの強酸と強塩基の溶液を混合すると,10⁻8秒で半分反応し,10⁻6秒で99%反応することになる。この値は理論的にも水溶液中の反応速度として最大のものであると予想される。水溶液中で反応が進むためには,まず反応物質が溶液中を移動(拡散)する間に2個以上の分子が遭遇(衝突)しなければならない。遭遇した分子間で迅速に反応が進むならば,遭遇の速度が全体としての反応速度も決めてしまうであろう。水溶液中での拡散速度から反応物質が相互に遭遇する頻度(気相反応での衝突数に相当する)を推定すると,多くのイオンで109~1010l/mol・sの程度,最も速いオキソニウムイオンH3O⁺,水酸化物イオンOH⁻に対して1.3×1011l/mol・sとなる。この値は中和反応速度とよく一致し,中和反応はH3O⁺とOH⁻が拡散し遭遇すると直ちに反応し,反応速度は遭遇の速度により決められていることを示している。このような反応を拡散律速の反応という。
水素とハロゲンの反応
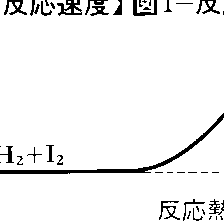
水素とヨウ素の反応H2+I2⇄2HIは1897年ドイツのボーデンシュタインErnst August Max Bodenstein(1871-1942)により研究され,283~508℃の範囲で正逆両反応とも二次反応であることが確かめられた。反応速度式が化学反応式の係数どおり二次になることは,この反応が単純な反応で,二つの分子の衝突により直ちに原子の組替えが起こることを示している。正反応の活性化エネルギーが163kJ,逆反応の活性化エネルギーが178kJ,その差-15kJが反応熱に等しいことから,この反応経路をエネルギー的に図1のように描くことができる。二つの分子が反応するためには,活性化エネルギーに相当するエネルギーの山を越さなければならない。ボーデンシュタインは引き続いて水素と臭素の反応H2+Br2─→2HBrの研究にとりかかったが,初めの予想に反して簡単な反応速度式は見いだせなかった。苦心の末,1907年になって200~300℃の範囲で次の反応速度式を実験的に求めることができた。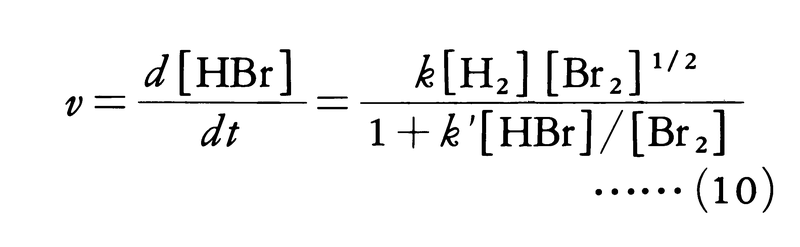
しかし彼は水素と臭素の反応がなぜこのような複雑な速度式にしたがうのか解明することができなかった。この疑問は,1919年にクリスチャンセンJens Anton Christiansenにより解明された。この反応は次のような段階を経て起こる。
Br2⇄2Br ……(i)
Br+H2⇄HBr+H ……(ii)
H+Br2⇄HBr+Br ……(iii)
ここでBrは臭素原子,Hは水素原子であり,これらは反応物のH2やBr2,生成物のHBrに比べて非常に不安定であるが,反応が進んでいる過程で微量ではあるが生成し,反応を進める仲介となる。このような化学種を反応中間体という。反応が一定速度で進んでいるとき,これらの反応中間体の濃度はほぼ一定に保たれている。このように考えて,反応速度式(10)を説明することができる。水素と臭素の反応は,このようにいくつかの反応の組合せの結果として起こる。全体の反応を組み立てるそれぞれの反応段階を素反応という。先に示した水素とヨウ素の反応のように,一つの素反応から成る反応を単純反応というのに対し,水素と臭素の反応のように,いくつかの素反応の組合せの結果として起こる反応を複合反応という。ほとんどの反応は複合反応である。水素と塩素の反応は,ヨウ素や臭素の場合とまた様子が異なり,光や電気火花などにより反応が開始されると,爆発的に反応が進行する。光で開始される場合,光のエネルギーをhν(νは振動数,hはプランク定数)で表せば,この反応機構は次のように書ける。
Cl2+hν─→2Cl・ ……(i)
Cl+H2─→HCl+H ……(ii)
H+Cl2─→HCl+Cl ……(iii)
この反応機構は水素と臭素の反応機構と形式的に似ているが,両者で本質的に異なる点は,水素-臭素の反応では,(ii)(iii)の素反応段階の逆反応がかなりの速度で起こるのに対し,水素-塩素の反応では,素反応段階(ii)(iii)の逆反応は無視されるほど少なく,これらの素反応がくり返し起こる。(ii)の反応で生成したHが(iii)の反応を起こし,これにより生成したClが再び(ii)の反応を引き起こすといったように,HとClが連鎖の担体となって反応が進む。すなわち,この場合には反応中間体のH,Clが一定濃度に達せず急激に増大するので,反応速度は一定の定常値を示さず,時間とともに増大して,爆発的に反応が進むことになる。このような反応を連鎖反応といい,連鎖が開始されてから停止するまで,平均して何回連鎖がくり返されるかを示す数を連鎖の長さという。水素-塩素の反応では連鎖の長さは104~106に達する。
素反応過程
化学反応が進む途中に比較的安定な反応中間体を含むとき,反応経路は図2に模式的に示したように,いくつかのエネルギーの山をもった反応経路をとるようになる。一つのエネルギーの山をはさんだ段階が素反応に相当する。そこで,一般に化学反応の速度を理論的に求めるためには,反応がどのような素反応から成り,それぞれの素反応がどのような速度で進むかを知らなければならない。このためには,まずエネルギーの山の高さ,すなわち活性化エネルギーの大きさを知る必要がある。すでに示した水素-ヨウ素の反応は単一の素反応から成る単純反応で,その活性化エネルギー(163kJ)は,水素分子H2とヨウ素分子I2をともに原子状に解離した状態2H+2Iにまでもっていくのに必要なエネルギー(649kJ)に比べて,非常に小さい。このことは,この反応が水素とヨウ素分子が原子状に解離し,それらが結合してヨウ化水素HI分子を形成するといった形で起こるわけではなく,もっとエネルギー的に楽な反応経路を通って進むことを示している。この反応経路で最もエネルギー的に高い状態にある反応系化学種を活性錯合体と呼ぶ。活性錯合体の構造の究明は,1925年に量子力学が確立され,化学結合のエネルギーが理論的に求められるようになって急速に進んだ。この方法から,種々の配置をとる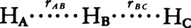 三原子系のエネルギーを求めることができる。三つの水素原子は直線上にあるとし,二つの水素原子間距離rabとrbcを変数としてエネルギーを求め,等しいエネルギー値をもつ点を等高線として結ぶと,図3に示す結果が得られる。この図は水素分子と水素原子の反応H2+H─→H+H2に対する反応の道すじとともに,そのエネルギー変化を示している。反応は最もエネルギーの低い道を選んで進んでいく。初めHAとHBが水素分子H2をつくっていて,これがHCと反応するとすれば,図3で反応は左上から点線で示された道をたどり,右下の方向へ進んでいく。この道で最もエネルギー値の高いところが活性錯合体の状態に相当し,そのエネルギーの高さが活性化エネルギーになる。山越えの道を例にとれば,反応経路は鞍部の峠道に相当し,峠の標高が活性化エネルギーを与えることになる。
三原子系のエネルギーを求めることができる。三つの水素原子は直線上にあるとし,二つの水素原子間距離rabとrbcを変数としてエネルギーを求め,等しいエネルギー値をもつ点を等高線として結ぶと,図3に示す結果が得られる。この図は水素分子と水素原子の反応H2+H─→H+H2に対する反応の道すじとともに,そのエネルギー変化を示している。反応は最もエネルギーの低い道を選んで進んでいく。初めHAとHBが水素分子H2をつくっていて,これがHCと反応するとすれば,図3で反応は左上から点線で示された道をたどり,右下の方向へ進んでいく。この道で最もエネルギー値の高いところが活性錯合体の状態に相当し,そのエネルギーの高さが活性化エネルギーになる。山越えの道を例にとれば,反応経路は鞍部の峠道に相当し,峠の標高が活性化エネルギーを与えることになる。
反応の経路が明らかになることによって,反応速度を予測できるようになった。現在広く用いられている方法は,1936年アイリングHenry Eyring(1901-81)らにより開発された方法で,反応経路で最もエネルギーの高い状態,すなわち活性錯合体をつくる状態を遷移状態と呼び,これが反応系の初めの状態とほぼ平衡にあると仮定する。これにより活性錯合体の濃度が求められ,これに活性錯合体が生成物に変化していく速度を乗じることにより,この素反応の速度が求められる。最も高い活性化エネルギーをもつ素反応段階が律速段階となり,全体の反応速度を定める。この方法を遷移状態理論あるいは絶対反応速度論という。反応速度を理論的に予測する方法として,このほかに,反応経路のエネルギー面上を与えられたエネルギーをもつ反応分子が登っていく様子を,力学の法則を用いて直接算出して求める分子力学の方法がある。コンピューターの発達でこのような複雑な計算も可能になり,これらの研究により化学反応が進む様子を限りなく詳細に再現することができるようになってきた。
→化学反応 →活性化エネルギー →反応中間体
執筆者:妹尾 学
工学的反応速度論
化学反応を,工業的生産を目的として利用する場合,反応の物理化学的な機構,その反応の進行についての知見だけでなく,その目的に合致するよう,工学的な過程として取り扱うことが必要となる。ほとんどすべての化学反応が工業的に利用されているが,その場合,流通式あるいは回分式で,それぞれの反応に適した装置が用いられている。この際,反応速度を大きく,目的生成物の選択性の高い反応環境をつくるため,種々の触媒の添加,複雑な操作条件の選択が行われる。したがって,装置内の反応は単純なものは少なく,いくつもの反応過程が複雑に組み合わさった形で進行することが多い。また反応速度に装置形状,あるいは操作因子が影響を与える。このことは,とくに固体触媒,あるいは気液系など,異相間の反応において問題となる。また工業生産の立場からは,反応における個々の生成物の生成速度を知る必要のない場合も生ずる。むしろ,いくつかの目的生成物の総量,他の副生成物の総量とに分けて,それらの速度式が定式化されれば十分な場合も多い。このような工学的観点にたって,反応速度が解析され,定式化されることが必要で,それが工学的設計(反応装置設計,操作条件の選定,制御)に利用される。このような設計のための速度式は,しばしば化学反応機構に対応しない形が使われたり,また装置により異なるものが用いられることもある。通常,反応速度式は,重要な濃度変数について,べき関数の形にまとめられる。このべき数(α,β,γなど)は,整数値とは限らず,細かな実数であることが多い。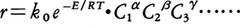
これは,速度式を得るため,小規模反応装置(固体触媒充てん層では単一触媒充てん管実験)で,操業条件をはさんで,種々の因子(濃度,温度,流量……)を変化させ,原料物質消失速度,目的生成物生成速度等を測定し,速度と濃度の関係を対数整理によってまとめ,速度式を導出することが多いためである。したがって得られた速度式は,測定範囲内の反応挙動を十分模擬(シミュレーション)することができ,装置設計の基礎として有効に利用されている。しかしながら,このような総括的な速度式は,装置運転における開始や停止,さらには事故など,装置と操作条件の大きな変化に対応できるとは限らない。反応装置内では,化学反応と種々の物質の移動過程,流動が複雑にからみ合って,反応が進行している。この装置内の状況を詳細に解析し,定量的に表現することができれば,広い操作条件の変動にも対応できる反応の模擬が可能となる。コンピューターの発達とともに,このような解析が盛んになり,より信頼性の高い装置設計,反応に最適な装置の開発が行われるようになった。
移動過程の反応に及ぼす影響は,具体的にいろいろな形で現れる。たとえば,吸熱反応であるナフサの熱分解反応が工業装置で行われている場合は,その反応管への熱の供給が反応の律速過程となっている。また触媒反応では,多孔質担体に担持された触媒が広く用いられるが,担体細孔内拡散過程が反応を律する場合も多い。そのほか,気液反応では気液界面での物質移動など異相反応系で種々の移動過程が全体の反応速度に影響を与えるので,混合,移動などの過程を含めた反応の解析が重要である。
→反応工学 →反応装置 →物質移動
執筆者:井上 博愛
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「反応速度」の意味・わかりやすい解説
反応速度
はんのうそくど
reaction rate
化学反応の進む速さをいう。化学反応には火薬の爆発のようにきわめて速い反応、水溶液中での金属イオンの沈殿反応のような速い反応から、デンプンの加水分解反応、湿った空気中での鉄片が錆びる反応などのようにゆっくりとした反応がある。これらの反応速度は、単位時間内に反応物質(反応の原系または生成系の物質)の量がどれだけ変化したかという割合で表す。反応物質の量としては、溶液の場合はその物質の濃度、気体の場合はその物質の圧力(分圧)を用いることが多い。たとえば、
aA+bB―→cC+dD
の反応で、その速度vは、
で表される。この速度の実測結果が、反応の原系の物質(反応物)の濃度([ ]をつけて表す)に次式のような形で表される場合、
v=k[A]m[B]n
mまたはnはそれぞれAまたはBについての反応の次数といい、m+nを全反応の次数という(m、nはそれぞれa、bに等しい場合も、そうでない場合もある)。m=1,n=1の場合、全反応の次数は2、すなわち二次反応であるという。この場合、反応物の初濃度がわかっていて、それぞれaおよびbであり、ある時刻までにxだけの濃度分が反応してしまったとすれば、残りの濃度は、a-xであるから、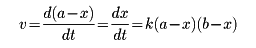
ここで比例定数kを速度定数という。kはA、Bがいずれも単位の濃度のときの速度なので比速度ということもある。
化学反応には、つねに反応式の右向きの反応(正反応)と同時に左向きの反応(逆反応)がおこっている。
逆反応の実測からその速度v'が、
v'=k'[C]p[D]q
で表されたとするとき、k'を逆反応の速度定数という。反応が平衡に達すればv=v'であり、質量作用の法則が導かれる。
反応速度は反応物質の濃度以外に温度にも依存する。速度定数の温度依存は、
k=Aexp(-Ea/RT)
で表すことができる。ここにEは活性化エネルギー、Tは絶対温度、Rは気体定数、またAは定数である。この式をアレニウス式という。普通の反応では室温付近で温度が10℃上がると速度が2~4倍ぐらいになる。これは活性化エネルギー(反応が進むために乗り越えなければならないエネルギー障壁の高さに相当する)が1モル当り12~24キロカロリーであることを意味する。
[戸田源治郎・中原勝儼]
『長哲郎編『共立化学ライブラリー8 反応速度』(1974・共立出版)』▽『秀島武敏著『現代物理化学講義――化学熱力学と反応速度』(1996・培風館)』▽『斎藤勝裕著『反応速度論』(1998・三共出版)』▽『慶伊富長著『反応速度論』第3版(2001・東京化学同人)』
百科事典マイペディア 「反応速度」の意味・わかりやすい解説
反応速度【はんのうそくど】
→関連項目オストワルト|化学反応|活性化エネルギー|速度
出典 株式会社平凡社百科事典マイペディアについて 情報
化学辞典 第2版 「反応速度」の解説
反応速度
ハンノウソクド
reaction rate, reaction velocity
化学反応の進行する速さ.一つの化学反応式で表示されるような反応では,反応原系のいずれか一つの成分の単位時間当たりの減少量,あるいは生成物質のいずれか一つの成分の単位時間当たりの増加量で表される.たとえば,
3H2 + N2 → 2NH3
では,
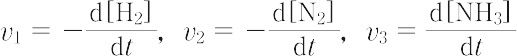
はいずれも反応速度を表し,
v1 = 3v2 = (3/2)v3
の関係があるが,定義さえ明確にすれば便宜上いずれを用いてもさしつかえない.可逆反応では,とくにことわらないかぎり,反応速度は正反応の速度 と逆反応速度
と逆反応速度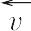 の差をさす.
の差をさす.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「反応速度」の意味・わかりやすい解説
反応速度
はんのうそくど
reaction rate; reaction velocity
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
関連語をあわせて調べる
今日のキーワード
焦土作戦
敵対的買収に対する防衛策のひとつ。買収対象となった企業が、重要な資産や事業部門を手放し、買収者にとっての成果を事前に減じ、魅力を失わせる方法である。侵入してきた外敵に武器や食料を与えないように、事前に...
お知らせ
4/12 日本大百科全書(ニッポニカ)を更新
4/12 デジタル大辞泉を更新
4/12 デジタル大辞泉プラスを更新
3/11 日本大百科全書(ニッポニカ)を更新
2/13 日本大百科全書(ニッポニカ)を更新