日本大百科全書(ニッポニカ) 「電位差滴定法」の意味・わかりやすい解説
電位差滴定法
でんいさてきていほう
potentiometric titration
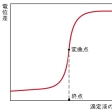
電気滴定の一種で、滴定反応にあずかっている化学種の濃度変化に対応した電位差の変化を測定して終点を決定する方法。測定容器内に適当な指示電極と基準電極を入れ、標準液を滴下するごとにその電位差を測定する。中和滴定ではガラス電極を指示電極とし、カロメル電極または銀‐塩化銀電極を基準電極とし水素イオン濃度指数(pH)を測定するのが普通である。終点は、標準液の微小一定量に対して電位差の変化が極大となった点、または滴定曲線を描いて作図から求める。種々の滴定に広く利用されている。また、特定イオンに選択的に感応する種々のイオン選択電極が数多く開発され、これらを指示電極に用いる新しい応用分野が発展している。
[高田健夫]
[参照項目] | | |