内科学 第10版 の解説
造血幹細胞移植の原理と実際の流れ(造血幹細胞移植術)
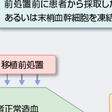
造血器腫瘍のように抗癌薬への感受性が高い腫瘍は,抗癌薬の投与量を高めるほど強い抗腫瘍効果が得られやすい.しかし,放射線照射や抗癌薬は投与線量/投与量を増加させていくと,ある一定の投与量(最大耐容量,maximal tolerated dose:MTD)をこえた時点で何らかの毒性のために(用量規定毒性,dose limiting toxicity:DLT)それ以上の増量が不可能となる.多くの抗癌薬においてDLTは骨髄抑制である.造血幹細胞移植とは,抗腫瘍効果を高めるためにMTDを上回る大量の抗癌薬や全身放射線照射を用いた強力な治療(移植前処置)を行って,患者骨髄とともに悪性腫瘍を壊滅に導き,その後にドナー由来(同種)の,あるいはあらかじめ凍結保存しておいた患者自身(自家)の造血幹細胞を輸注することによって造血能を補う治療法である(図14-8-1).さらに同種移植の場合はドナーリンパ球による抗腫瘍効果(移植片対白血病graft versus leukemia(GVL)効果)が得られることがある.一方,再生不良性貧血などの非腫瘍性疾患に対しては,正常造血の再構築を目的として同種造血幹細胞移植が行われる.
造血幹細胞とは白血球,赤血球,血小板のすべての造血細胞に分化する能力と,自己複製能力を有する細胞である.通常は骨髄内に存在するが,化学療法後の骨髄回復期や顆粒球コロニー刺激因子投与後に末梢血中に動員されること,臍帯血中にも含まれていることが判明した.そのため,造血幹細胞移植は造血幹細胞の採取方法によって骨髄移植(bone marrow transplantation:BMT),末梢血幹細胞移植(peripheral blood stem cell transplantation:PBSCT),臍帯血移植(cord blood transplantation:CBT)に分類される.
固形臓器の移植では免疫系は患者の免疫が維持されるのに対して,造血幹細胞移植においては免疫系もドナー細胞に置換される.移植されたドナー免疫細胞と患者臓器は免疫学的に寛容状態になり,多くの場合,長期的には免疫抑制薬を完全に中止することが可能となる.移植後の免疫抑制薬の投与の目的は,固形臓器移植においては移植片拒絶の予防であるが,造血幹細胞移植においては移植片対宿主病(graft-versus-host disease:GVHD)の予防がおもな目的となる.造血幹細胞移植では移植前処置によって患者免疫力が抑制されているため移植片拒絶の頻度は低い.
(2)造血幹細胞移植の流れ(図14-8-2)と合併症
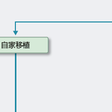
まず病状や臓器機能などの全身的な評価を行って移植適応の有無を検討する.そして,自家移植の適応と判断された場合は患者本人の造血幹細胞(通常は末梢血幹細胞)を採取,凍結保存した後に,移植前処置を行い,凍結幹細胞を解凍して輸注する.
一方,同種移植の適応と判断された場合は,適切なドナーが存在するかどうかを調査する.まずは理想のドナーであるHLA適合血縁者の有無について,患者本人および血縁ドナー候補者の同意を得てからHLA型の検査を行う.HLA適合血縁ドナーが得られない場合には必要に応じて骨髄バンク,さい帯血バンクの検索やHLA不適合血縁ドナーの検索を行う.これらのドナーからの移植はHLA適合血縁ドナーからの移植よりも合併症のリスクが高くなるので,移植適応について再検討すべきであるが,日本国内の非血縁者間移植では遺伝子レベルで適合度の高いドナーからの移植であれば血縁者間移植と同等の成績が得られている(Kandaら,2012).血縁ドナーの場合はドナーの健康診断を実施して,ドナーとしての適格性を判定する.状況によっては骨髄採取あるいは末梢血幹細胞採取のいずれか一方のみが不適格と判断される場合もあり得る.移植前にもう一度患者の病状,臓器機能などの評価を行い,ドナーとの関係なども含めて総合的に判断し,移植前処置,GVHD予防法,感染症対策を決定する.
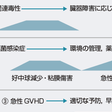
移植前処置を行い,通常は移植前日から免疫抑制薬投与を開始し,移植日にドナー造血幹細胞を輸注する.ドナーからの幹細胞採取は患者の移植日にあわせて行うか,あるいは末梢血幹細胞採取の場合は前処置開始前に採取して凍結保存しておくこともある.移植日以後,少なくとも数年間にわたって移植後合併症の管理が必要である(図14-8-3).合併症の予防と治療については別項に詳述されている.【⇨14-8-6)】
(3)移植前処置
移植前処置の目的は悪性腫瘍を根絶させることと,同種移植においてはドナー造血細胞が拒絶されないようにホストの免疫を抑制することである.したがって自家移植の場合は抗腫瘍効果だけを考えて各疾患に対して有効性の高い抗癌薬の組み合わせ,すなわち,リンパ腫に対するBEAM療法(カルムスチン,エトポシド,シタラビン,メルファランの併用)や骨髄腫に対する大量メルファラン療法などが行われる.一方,同種移植で最も標準的に用いられている前処置法は大量シクロホスファミドとTBI(total body irradiation:全身照射)の組み合わせ(CY-TBI)である.TBIを用いない前処置としてはブスルファン(BU)とCYの組み合わせ(BU-CY)が広く用いられている.
TBIは強力な免疫抑制作用をもつこと,さまざまな腫瘍に有効であり,また,化学療法に耐性の腫瘍でも効果が期待できること,中枢神経領域などの化学療法薬が到達しにくい領域にも有効であること,そして10~12 Gyにおいては骨髄以外の臓器に重篤な合併症を生じる危険性が低いことから,移植前処置の一部として適している.TBIを含まない前処置(非TBI前処置)は,縦隔などに多量の放射線照射を受けている患者に適していることや,小児の成長障害を回避できるなどの利点がある.TBIを含む前処置とBU-CYの優劣に関する複数の臨床試験の結果から判断すると,白血病に対する同種移植ではCY-TBIはBU-CYと比較して同等あるいはややすぐれていると考えられる.また,BUはTBIと比較するとリンパ球に対する効果が劣ることから,一般的にリンパ系腫瘍ではCY-TBIが優先的に選択される.
高齢者や臓器障害を有する患者に対する同種移植では移植前処置の強度を弱めたミニ移植が行われている.多くの場合,免疫抑制効果の強いフルダラビンにアルキル化薬を加えた前処置が行われる.また,再生不良性貧血などの非腫瘍性疾患に対する同種移植では,抗腫瘍効果を求める必要はなく,ドナー造血幹細胞を生着させるために患者の免疫力を抑制することが前処置の目的となるので,CYやフルダラビンなどの免疫抑制力の強い抗癌薬が用いられる.
(4)造血幹細胞の採取
a.ドナーの適格性の判断
ドナーの立場からの適格性の判定と,自由意思に基づく同意取得のために,血縁者間移植においても非血縁者間移植と同様に,ドナーを担当する医師は患者担当医とは異なることが望ましい.同意が得られたら,安全な幹細胞採取が可能かどうかを判断するために健康診断を行う.骨髄採取では通常は血液内科医師のほかに麻酔科医師による適格性判断が行われるが,末梢血幹細胞採取においても血液内科医師以外の立場の医師による確認を行うことが望ましい.
b.骨髄採取
骨髄採取は全身麻酔下にて腹臥位で行う.採取する目標有核細胞数は患者体重1 kgあたり3.0×108個であるが,ドナー体重などから計算して設定した採取上限量をこえる採取は行わない.多量の骨髄液の採取はそれと等量の出血に相当する負担となる.したがって,健常ドナーにおいては同種血輸血を避けるために自己血の貯血が必要となる.
c.末梢血幹細胞採取
末梢血幹細胞採取では,まず骨髄中の造血幹細胞を末梢血中に動員しなければならない.造血幹細胞の動員は健常ドナーではG-CSF単独で行われ,自家移植の患者では通常は化学療法とG-CSFの併用で行われる.実際の採取は自動化装置に末梢血を循環させ,遠心分離によって幹細胞を多く含む層を形成し,その層だけを採取して残りの血液を体内に戻す.採取の目標はCD34陽性細胞数を指標して自家移植の場合は患者体重1 kgあたり1.0~2.0×106個,同種移植の場合は患者体重1 kgあたり1.0~3.0×106個を目安とする.
(5)造血幹細胞の凍結保存と移植(輸注)
a.造血幹細胞の凍結保存
自家造血幹細胞移植の場合,あらかじめ造血幹細胞を採取しておいて前処置を行った後に輸注するため,いったん凍結保存するという操作が必要になる.同種造血幹細胞移植でも特に末梢血幹細胞移植では十分な細胞数が採取できたことを確認してから移植前処置を開始するという目的で凍結保存される場合がある.骨髄液を凍結保存する場合は凍結前に赤血球除去を行う必要がある.赤血球除去は通常は末梢血幹細胞採取の際に用いられる自動化装置を利用して行われる.
b.造血幹細胞の輸注
同種造血幹細胞移植の輸注時には患者とドナーの赤血球型の不適合に注意を要する.赤血球型の不適合は,患者血漿中にドナー赤血球抗原に対する抗体が存在する場合(例:患者O型,ドナーA型)を主不適合(major mismatch),ドナー血漿中に患者赤血球抗原に対する抗体が存在する場合(例:患者A型,ドナーO型)を副不適合(minor mismatch),患者血漿中にドナー赤血球抗原に対する抗体が存在し,かつドナー血漿中に患者赤血球抗原に対する抗体が存在する場合(例:患者A型,ドナーB型)を双方向不適合(bidirectional mismatch)という.ABOの主不適合,RhDの主不適合(患者がRhD(−),ドナーがRhD(+)),その他患者が有する何らかの不規則抗体に対応する抗原がドナー赤血球に発現している場合は赤血球除去処理が必要となる.逆に副不適合が存在する場合には骨髄液中の血漿除去が必要となる.骨髄バッグを遠心分離して上清を生食に置換する方法が広く行われている. 凍結していない骨髄液を輸注する場合は,赤血球ABO型適合あるいは副不適合の場合はクロスマッチを行い,陰性であることを確認する.陽性の場合は赤血球除去処理を行ってから輸注する.凍結末梢血幹細胞あるいは凍結骨髄を輸注する場合は,輸注のために解凍する際に浸透圧変化に伴う細胞内成分の希釈や,再氷晶形成による細胞傷害が生じえる.そのため,通常は37℃の恒温槽を用いた急速解凍が行われている.解凍した後は速やかに輸注が行われる.
(6)造血幹細胞移植後の輸血
移植後の血液製剤投与の目安は通常の化学療法時と同様であり,ヘモグロビン値で7~8 g/dL,血小板数で20000/μLを維持するように輸血を行う.ただし,消化管出血など活動性の出血がある場合には血小板はより高値を目標とする.
ABO型副不適合の同種造血幹細胞移植では輸注した幹細胞液の血漿中の抗体や輸注されたリンパ球から産生された抗体によって患者赤血球の溶血を生じる可能性がある(O’Donnell,2004).さらに移植後7~14日頃の急激な溶血に注意が必要である.輸血を行う場合は,赤血球はドナー型,血小板とFFPは患者型を用いる. 一方,ABO型主不適合を伴う同種造血幹細胞移植後は患者体内の抗体によって,輸注した幹細胞液の赤血球や輸注された幹細胞から分化された赤芽球および赤血球の溶血を生じる可能性がある.移植後も患者抗体が長期間にわたって残存することもあり,その場合は赤芽球癆様の病態を呈する.輸血を行う場合は,赤血球は患者型,血小板とFFPはドナー型を用いる. 患者A型,ドナーB型のような双方向不適合においては副不適合,主不適合両者の合併症を生じる可能性がある.輸血を行う場合は,赤血球はO型,血小板とFFPはAB型を用いる. これらの赤血球型不適合移植における特殊な輸血方法は移植後にA,B抗原,抗A,B抗体価などをモニターし,患者の血液型が完全にドナー型に変わるまで続ける.
(7)移植後の再発
移植後のさまざまな合併症を乗り越え,そして移植後3~5年経過して原疾患の再発がないことを確認して,はじめて移植が成功したということができる.しかし,再発は移植が失敗に終わる最大の理由の1つであり,特に非寛解期の白血病や悪性リンパ腫に対する移植後に再発が多い.移植後の再発に対しては,GVL効果を期待して免疫抑制薬を急速に中止したり,ドナーリンパ球を輸注したりすることが試みられているが,その効果は限定的である.再移植によって一部の患者に根治が得られている.[神田善伸]
■文献
Hartman AR, Williams SF, et al: Survival, disease-free survival and adverse effects of conditioning for allogeneic bone marrow transplantation with busulfan/cyclophosphamide vs total body irradiation: a meta-analysis. Bone Marrow Transplant, 22: 439-443, 1998.
Kanda J, Saji H, et al: Related transplantation with HLA 1-antigen mismatch in the graft-versus-host direction and HLA 8/8-allele-matched unrelated transplantation: A nationwide retrospective study. Blood, 119: 2409-2416, 2012.
O’Donnell MR: Blood group incompatibilities and hemolytic complications of hematopoietic cell transplantation. In: Thomas’ Hematopoietic Cell Transplantation, 3rd ed (Blume KG, Forman SJ, et al eds), pp824-832, Blackwell Science, 2004.
出典 内科学 第10版内科学 第10版について 情報