内科学 第10版 の解説
増殖・浸潤・転移関連分子(腫瘍)
(1)増殖にかかわる分子
種々の細胞増殖因子が,その受容体と下流のシグナルを活性化することにより核に増殖促進のシグナルを伝えることが知られている.増殖因子受容体の多くはチロシンキナーゼであるが,癌細胞においては増殖因子に依存せずこのシグナルが恒常的に活性化している場合がある.上皮細胞増殖因子EGFの受容体EGFR,肝細胞増殖因子HGFの受容体c-METをはじめとしてErbB2,RET,c-KIT,ALKなどの増殖因子受容体の変異が特定の癌で見つかり,それによって受容体がチロシンキナーゼとして活性化していることが報告されている.これらの分子のキナーゼ活性を抑える分子は,癌の分子標的薬として早い時期から臨床応用されている.
また増殖因子受容体の活性化のシグナルを核に伝える低分子量G蛋白質のRas,セリンスレオニンキナーゼのRaf,脂質キナーゼのホスファチジルイノシトール3キナーゼ(PI3K)などの分子も一部の癌で変異がみられ,癌の無限増殖や生存を支えるものと考えられている. 核内の転写因子であるMycファミリーは増殖や細胞死にかかわる分子群の制御にかかわっているが,癌においては遺伝子増幅などによる発現異常がみられ,癌の悪性形質にかかわっている.JunとFosのヘテロ二量体によって形成されるAP-1転写因子は,癌化に伴った活性化が認められ,癌における増殖,分化,細胞死の調節異常にかかわるとされる. 細胞が増殖を行うためには細胞分裂が必要であるが,細胞分裂を繰り返す一連の過程は細胞周期とよばれ,サイクリン-CDK複合体を中心とした多くの分子群により巧妙に調節されている.癌においてはサイクリンDなどの増加による細胞周期の加速がみられる.またRB,p16,p53などの癌抑制因子は正常細胞では細胞分裂を制御するブレーキの役割をしており,癌においてはこれらの蛋白質が欠損することが増殖のコントロールが崩れる原因となる.
(2)浸潤・転移にかかわる分子
細胞外マトリックスには,コラーゲン,フィブロネクチン,ラミニン,プロテオグリカンなど多様な成分があり,結合組織と基底膜を構成している.
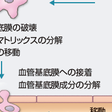
細胞外の環境の制御において,プロテアーゼは重要である.ほとんどは,メタロプロテアーゼ,セリンプロテアーゼである.細胞外マトリックスを分解するMMP(matrix metalloproteinase)は癌の浸潤・転移には中心的な役割を演じている(図1-4-9).MMPファミリーは少なくとも23種類は知られている.
血管基底膜成分(主成分Ⅳ型コラーゲン)の分解には,マトリックスメタロプロテアーゼ(MMP)遺伝子ファミリーであるMMP-2,MMP-9と膜型MMP(MT-MMP)の役割が知られている.膜型MMP,特にMT1-MMP(MMP-14)は,ゼラチナーゼAの活性化とコラーゲンなどの細胞外マトリックスを分解する蛋白質分解酵素であり,浸潤・転移を促進する.MT1-MMPを標的とした癌の治療の可能性が考えられるゆえんである. 間質の主成分はⅠ型コラーゲンである.Ⅰ型コラーゲンを切断するものとしては,MMP-1,MMP-8,MMP-13,MMP-14(MT1-MMP)などが知られている. インテグリンは,細胞-細胞外マトリックス間接着としての機能以外に,細胞内のシグナルを伝える「シグナル分子」としても知られている. ヒアルロン酸受容体のCD44は細胞外マトリックスに対する接着分子であるが,RasおよびRhoファミリーのような細胞運動を制御する分子を介したシグナルを介し,膜型メタロプロテアーゼにより膜外部で切断を受けて,癌細胞の増殖および浸潤・転移を制御している. E-カドヘリンは上皮細胞間接着にかかわる重要な分子であり,この機能喪失により細胞接着が不活化され,癌浸潤先端での脱分化や血行性転移に関与している.βカテニンの機能喪失によりカドヘリン細胞接着系が不活化する. CA19-9(シリアルLea)は,血管内皮細胞の細胞接着分子であるE-セレクチンと結合することで血管浸潤や血行性転移にかかわる.
MUC1は細胞間結合阻害因子として働き,癌において局所浸潤,転移に関与する. 癌化した細胞の糖鎖は「癌マーカー」としてのほかに,転移との関連においても研究が進められている.糖転移酵素GnT-Vと転移とのかかわりが知られている.
最近は,浸潤,転移に関して,癌の微小環境が注目されている.原発巣の癌細胞の骨髄細胞の動員,さらにpremetastatic siteへの影響も分子レベルで報告され注目されている.以前から広く知られている「種子と畑説」(seed and soil theory)の新しい展開でもある.[中釜 斉]
■文献
Blume-Jensen P, Hunter T: Oncogenic kinase signaling. Nature, 411: 355-365, 2001.
出典 内科学 第10版内科学 第10版について 情報