日本大百科全書(ニッポニカ) 「有機ハロゲン化物」の意味・わかりやすい解説
有機ハロゲン化物
ゆうきはろげんかぶつ
organic halide
広義には、ハロゲン化物イオンまたは共有結合したハロゲン原子を含む有機化合物の総称である。前者では、ハロゲン化物陰イオン(フッ化物イオンF-、塩化物イオンCl-、臭化物イオンBr-、ヨウ化物イオンI-)が有機陽イオンの塩として存在する。例としては、塩化トロピリウム[C7H7]+Cl-、塩化テトラオクチルアンモニウム(C8H17)4N+Cl-などがある()。
狭義に有機ハロゲン化物という場合は、炭素原子Cとハロゲン原子XがC-X共有結合(X=F、Cl、Br、I)を形成して結び付いている有機化合物をいう。
[廣田 穰 2016年11月18日]
分類
有機ハロゲン化物R-Xは、含まれているハロゲンXの種類と有機基Rの種類のそれぞれにより、次のように分類されている。
[廣田 穰 2016年11月18日]
ハロゲンXの種類による分類
有機フッ化物、有機塩化物、有機臭化物、有機ヨウ化物に分類される。
[廣田 穰 2016年11月18日]
有機基Rの種類による分類
脂肪族ハロゲン化物、芳香族ハロゲン化物、複素環式ハロゲン化物、ハロゲン化アシルなどに分類される。脂肪族ハロゲン化物は、さらに飽和のハロゲン化アルキル、不飽和のハロゲン化アルケニル、ハロゲン化アルキニルに分類される。
[廣田 穰 2016年11月18日]
命名法
有機ハロゲン化物には2通りの命名法がある。
[廣田 穰 2016年11月18日]
置換命名法
ハロゲンを置換基として取り扱い、骨格の炭化水素名の前に、(1)ハロゲンの位置を表す番号、(2)各ハロゲン原子の数を表す数詞接頭語(モノ‐、ジ‐、トリ‐……など)、(3)ハロゲンの種類を表す接頭語(フルオロ‐、クロロ‐、ブロモ‐、ヨード‐、一般名ハロ‐)をつけて命名する方法である。例をあげれば、CH3CHClCH2CH3は2-クロロブタン、CHBr3はトリブロモメタン、ClCH2CH2CHICH2CHClCH3は1,5-ジクロロ-3-ヨードヘキサンとよばれている。
この命名法は、2種類以上のハロゲンや多数個のハロゲンをもつ化合物の命名に便利である。
[廣田 穰 2016年11月18日]
性質と反応
脂肪族ハロゲン化物では、鎖式または脂環式のsp3混成炭素原子上にハロゲンがついているので、フッ化物や多塩化物以外は、反応をおこしやすい。ハロゲン原子はハロゲン化水素として脱離したり、ヒドロキシ基やアミノ基に置換されたりして、脂肪族ハロゲン化物からハロゲンが脱離していく。これと対照的に、芳香族ハロゲン化物では、ハロゲン原子が芳香環のsp2炭素原子についているので、非常に安定で、化学変化をおこしにくい。
脂肪族ハロゲン化物のうちで、フッ化物ではC-F結合エネルギー(結合生成による安定化エネルギーをいう)が大きいので、他の脂肪族ハロゲン化物に比べると安定である。脂肪族ハロゲン化物の炭素‐ハロゲン結合(C-X結合)の結合エネルギーがハロゲンの種類によりどのように違うかを比べてみると、フッ化物のC-F結合では441kJ/mol(1モル当りのキロジュール)、塩化物のC-Cl結合では328kJ/mol、臭化物のC-Br結合では276kJ/mol、ヨウ化物のC-I結合では240kJ/molであり、ハロゲンの原子量(原子番号)が大きくなるにしたがって結合エネルギーが小さくなっている。脂肪族ハロゲン化物の求核反応性はC-F<C-Cl<C-Br<C-Iの順でしだいに大きくなっていて、結合エネルギー減少の順序と一致している。ハロゲンの種類による反応性の違いは、分極率の増大による効果と考えられている。
脂肪族ハロゲン化物はハロゲン交換反応を行い、この反応は種々の有機ハロゲン化物を合成するのに使われている(後述の「脂肪族ハロゲン化物の製法」の項の「ハロゲン化アルキルのハロゲン交換」を参照)。このほかに、アミンやカルボン酸塩と反応して、これらをアルキル化するので、第一アミンのアルキル化やカルボン酸のエステル化に用いられている。
R-X+2R'NH2
―→R-NH-R'+R'NH3+Cl-(アルキル化)
R-X+R'COOK
―→R'-COOR(エステル化)
脂肪族ハロゲン化物は、エーテル中で金属状マグネシウムと反応してハロゲン化アルキルマグネシウムR-MgXを与える。
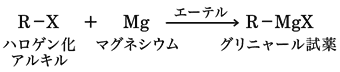
この化合物はフランスのグリニャールにより最初につくられたのでグリニャール試薬とよばれ、有機合成において重要なアルキル化試薬である。グリニャール試薬はブロモベンゼン、ヨードベンゼンなどの芳香族ハロゲン化物からも合成できるが()、クロロベンゼンからは生成しにくい。フルオロベンゼンはマグネシウムと反応しない。
一般に、フッ化物(脂肪族、芳香族とも)分子を構成しているフッ素原子と他の分子のフッ素原子の間の引力的相互作用は弱いので、フッ化物(とくに多フッ化物)の沸点は低くなっている。そのため、低分子量の脂肪族フッ化物は気化しやすいので冷媒などに用いられている(後述の「生活での利用と環境汚染」の項のフロンの解説を参照)。
[廣田 穰 2016年11月18日]
製法
脂肪族ハロゲン化物と芳香族ハロゲン化物では調製法は異なり、脂肪族の場合はハロゲン化物イオンX-による求核置換反応またはハロゲン原子によるラジカル的置換反応を応用する。これと対照的に、芳香族の場合はルイス酸触媒存在下における分子状ハロゲンX2による求電子的ハロゲン化により調製する。
[廣田 穰 2016年11月18日]
脂肪族ハロゲン化物の製法
ハロゲンとアルカンの光反応
アルカン(飽和炭化水素)に紫外線を照射しながらハロゲンを加えると、ハロゲンによる水素の置換がおこり、脂肪族ハロゲン化物が得られる。
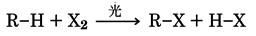
この反応は、ハロゲンX2が光により励起されて、ハロゲンラジカル(原子)を生ずるのが開始反応で、次の段階では、ここで生成したハロゲンラジカルがアルカンの水素を奪ってアルキルラジカルを生成する。このアルキルラジカルがハロゲン分子X2から1個のハロゲン原子をとってハロゲンラジカルを再生し、自らはハロゲン化アルキルになる。この反応によりできたハロゲンラジカルが同じ反応を繰り返すラジカル的連鎖反応により、ハロゲン化アルキルができる。
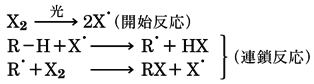
最後に系に残ったラジカルどうしの結合(カップリング)により反応が終わる。
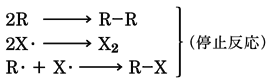
塩素化は発熱反応であるため、ハロゲンの添加量を制御しないと爆発的に反応し、のメタンの塩素化の例に示すように、反応は一置換体CH3Clで止まらず、二置換体CH2Cl2、三置換体CHCl3、四置換体CCl4のすべての混合物を生成する。臭素化やヨウ素化は吸熱反応であるので、光照射と加熱を同時に行わないとハロゲン化が円滑に進行しない。
[廣田 穰 2016年11月18日]
アルケンに対するハロゲンの付加
エチレンなどのアルケン(不飽和炭化水素)のC=C二重結合にハロゲンを付加させると、ジハロゲン化物(二ハロゲン化物)が得られる(ジハロゲン化物の調製)。塩素の付加には塩化鉄(Ⅲ)触媒が必要であるが、臭素は無触媒で付加する。
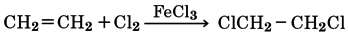
[廣田 穰 2016年11月18日]
アルケンに対するハロゲン化水素の付加
ハロゲン化水素の付加は、塩化水素HClやヨウ化水素HIの場合と臭化水素HBrの場合では、付加の向き(位置)が異なる。HClやHIの付加ではプロトンH+が先に付加しハロゲンは後で付加するが、HBrの付加では最初にHBrが光により分解して臭素ラジカルBr・になり、このラジカルが先にアルケンに付加する。Br・の生成には光が必要であるので、光を遮断してアルケンにHBrを付加させるとHClなどの他のハロゲン化水素と同じ向きの付加がおこる()。
[廣田 穰 2016年11月18日]
アルコールのヒドロキシ基のハロゲン置換
アルコールのヒドロキシ基OHをハロゲンXで置き換える反応である。アルコールにハロゲン化水素酸を加えて蒸留するとハロゲン化アルキルが得られる。この反応はハロゲン化物イオンX-による求核的置換反応である。
R-OH+HX―→RX+H2O
このハロゲン化は、アルコールに塩化チオニルSOCl2や三臭化リンPBr3などのハロゲン化試薬を反応させてもおこる。
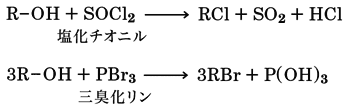
この種のハロゲン化試薬を使うと、カルボン酸をハロゲン化して酸ハロゲン化物にすることも可能である。
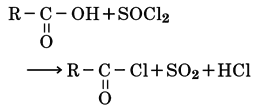
[廣田 穰 2016年11月18日]
芳香族ハロゲン化物の製法
芳香族ハロゲン化物のおもな製法をに示す。
分子状ハロゲンX2とルイス酸触媒を用いる合成
ベンゼンやトルエンなどの芳香族炭化水素に塩化アルミニウムAlCl3、塩化鉄(Ⅲ)FeCl3などのルイス酸を触媒として加えて、塩素Cl2を吹き込むと、塩素化される。トルエンの場合は、塩素化生成物としておもにo(オルト)-およびp(パラ)-クロロトルエンができ、m(メタ)-クロロトルエンは少量しかできない。この反応は臭素化にも広く応用でき、臭素化の場合は触媒として鉄粉を用いる。
[廣田 穰 2016年11月18日]
ザンドマイヤー反応による合成
アニリンと亜硝酸HNO2を0℃付近の低温で反応させるとジアゾニウム塩になる。これに適当なハロゲン化金属(塩)を加えるとハロゲン化ベンゼンが得られる。たとえば、ヨウ化カリウムKIを加えるとヨードベンゼンC6H5Iが得られる。またホウフッ化水素酸(テトラフルオロホウ酸)HBF4を加えて熱分解するとフルオロベンゼンC6H5Fが得られる。
[廣田 穰 2016年11月18日]
生活での利用と環境汚染
有機ハロゲン化物は、多種類のものが知られているが、天然に産するものは非常に少ない。土壌中の放線菌から得られる抗生物質のクロラムフェニコールやグリセオフルビン、地中海の巻き貝が産生するローマ紫、哺乳類(ほにゅうるい)の甲状腺(せん)が分泌するアミノ酸のチロキシンなどがその数少ない例で、いずれも芳香環上にハロゲンをもっている化合物である()。
現在、非常に応用範囲が広く、人々の生活になじみの深い人工の有機ハロゲン化物は、塩ビ、ビニル樹脂などとよばれているポリ塩化ビニル[-(CH2CHCl)n-]であろう。このほかにもいろいろな種類の人工の有機ハロゲン化物がさまざまな優れた性能と用途をもってデビューしてきたが、環境汚染などの汚名を着せられて消え去ったものも多い。
脂肪族多塩化物としては、塩化メチレン(ジクロロメタン)CH2Cl2、クロロホルム(トリクロロメタン)CHCl3、四塩化炭素(テトラクロロメタン)CCl4、トリクレン(トリクロロエチレン)HCCl=CCl2が工業的に生産されている。これらは化学的にかなり安定であり、有機物をよく溶かす難燃性の液体で、おもに溶媒や油類の洗浄剤、ドライクリーニングなどに用いられているが、水への溶解度が低く、しかも比重が大きいので、自然界に流出すると地下に浸透し、地下水を汚染する。これらの化合物のうち、いくつかは発癌(はつがん)性があるといわれ、使用が規制されている。
低分子量の脂肪族フッ化物は沸点が低く気化しやすいという性質を利用して、ジクロロジフルオロメタンCF2Cl2、ペンタフルオロクロロエタンC2F5Clなどのフルオロクロロアルカン(フロンの名で知られている)は冷媒やスプレーの加圧剤・クリーニング用溶剤などとして大量に生産されていた。しかし気化したフロンが高空のオゾン層に達したとき、太陽からの短波長紫外線によって分解されて塩素ラジカルを生じ、これが触媒になってオゾンが酸素に分解され、オゾン層の紫外線吸収力が低下することが知られた。このために有害な紫外線が地表に到達しやすくなって、人体や生態系に悪影響を与えるといわれ、現在では国際的にフロン類の使用が規制されている。
フッ化物、とくに多フッ化物(ポリフルオロ化合物)では、分子表面のフッ素原子が他の原子と相互作用しにくい性質をもっている。これを利用して、テフロン(ポリテトラフルオロエチレン-(CF2-CF2)n-)は、理科学実験用の容器や器具、調理器具・食器、医療用器具などに広く使われている。
芳香族ハロゲン化合物、とくに多塩素化物(ポリクロロ芳香族化合物)は、化学的に非常に安定で分解しにくいうえに、沸点が高く蒸発しにくいという特性をもっている。この特性を生かして、ポリ塩化ビフェニル(PCB)が熱媒体や電気絶縁体として使われ、多量に生産された。それよりも規模は小さいが、殺カビ剤のペンタクロロフェノール(PCP)、殺虫剤のDDTなどの農薬も工業的に製造されていた。しかし使用範囲が広がるにつれて、ポリクロロ芳香族化合物の人体や環境への影響の研究も進み、生体中で有毒物に変化することや代謝拮抗(きっこう)性を示すことなど、かなり高い生理活性をもっていて、環境への負の影響が大きいことが明らかになってきた。これらのポリクロロ芳香族化合物は現在では環境汚染物質としてその使用が禁止されている。PCPの製造やPCBの処理の際に、加熱・焼却により生成するポリクロロジベンゾ-p-ジオキシン(ポリ塩化ジベンゾ-p-ジオキシン)は、環境汚染物質で、「ダイオキシン」とよばれている。ダイオキシンは、1~8個の塩素Cl原子により置換されたジベンゾ-p-ジオキシンの総称であり、これらのうちで2,3,6,7-テトラクロロジベンゾ-p-ジオキシンがもっとも強い毒性をもっている。その毒性は、一般毒性、生殖毒性、発癌性、催奇形性に及んでいる()。
[廣田 穰 2016年11月18日]
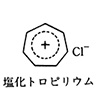
ハロゲン化物イオンを含む有機物の例〔図…
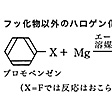
芳香族ハロゲン化物のグリニャール反応〔…
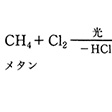
メタンの塩素化〔図C〕
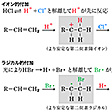
イオン的付加とラジカル的付加〔図D〕
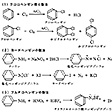
芳香族ハロゲン化物の製法〔図E〕
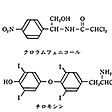
天然に産する有機ハロゲン化物〔図F〕
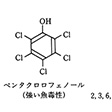
芳香族ハロゲン化物〔図G〕
