内科学 第10版 「間質性肺疾患」の解説
間質性肺疾患(呼吸器系の疾患)
(1)肺小葉構造とびまん性肺疾患:肺の炎症・線維化の場
肺の機能はガス交換にある.その実際の場は肺胞である.肺胞の形成・機能の理解には肺小葉(pulmonary lobule)という終末細気管支を中心とする径約2 cmの解剖単位の理解が必要である(図7-5-1).胎生期,空気の導管部である気管支の形成は24週までに17次分岐まで進み終末細気管支となり,それより末梢のガス交換の場,肺胞道,肺胞は胎生後期・出生後も形成が持続する.
一方,血管に関しては,肺動脈は終末細気管支まで気管支に併走するが,その後胎生15週前後に間葉系の血管群と吻合し,肺胞毛細血管がガス交換部となる.酸素化血は別経路で小葉間隔壁や胸膜を経て合流し,肺静脈となる.加えて肺小葉のリンパ走行をみると,リンパ管は気管支系では終末細気管支で一時消失し,小葉間隔壁で再度出現する.
こうした構造上の特徴は炎症に対して多様な反応を惹起し,びまん性肺疾患の場を形成する.たとえば骨髄移植後の閉塞性細気管支炎は提供者免疫細胞による宿主細気管支領域への炎症反応による肥厚であり,特発性肺線維症では小葉間隔壁近傍から肺胞虚脱や線維性変化が起こり,相対的に細気管支は拡張し蜂巣肺が形成される.
(2)間質性肺炎研究の歴史
後述するように肺線維化は60~70歳に多い.感染症が多く,平均余命の短かった20世紀前半では肺の線維化は顕在化せず,現在の急性間質性肺炎に相当するHamman-Rich症候群が記載されているのみである.20世紀後半に入り,病理所見を中心に線維化の解剖学的部位による分類,組織像の特徴による分類が始まった.中心的組織像として普通型間質性肺炎(usual interstitial pneumonia:UIP)が認識され(1967),対応する疾患名として特発性肺線維症(idiopathic pulmonary fibrosis:IPF)が使用された(1976).その後米国において積極的肺生検と治療反応性の知見集積から,IPFに類似するがステロイド反応性のよい組織像の存在が1980年代半ばより報告され始めた.これは世界的にも胸腔鏡下肺生検,高解像度CT(HRCT)が普及し,広く認識されるところとなった.これを受け,21世紀初頭,米・欧呼吸器学会で共通認識声明が出された.日本では2004年厚生労働省研究班の第四次診断基準改訂がこの声明に準拠し,疾患名称も変更された.10年を経てこれらは部分改訂され,現在ではこれに臨床試験のエビデンスが積み重ねられるようになった.
(3)現在の間質性肺炎の分類
びまん性肺疾患とは胸部X線写真で,左右,上下にびまん性に多様な陰影をみる疾患の総称である.びまん性肺疾患の中には原因が明らかな間質性肺炎を示す疾患群(薬剤誘発性,職業・環境暴露性,膠原病随伴性),肉芽腫形成性疾患群,その他肺リンパ脈管筋腫症(pulmonary lymphangioleiomyomatosis:LAM),肺Langerhans細胞組織球症(Langerhans cell histiocytosis:LCH),肺胞蛋白症など原因が別にある疾患群がある.しかしこれら疾患を除外してなお原因のわからない(これを「特発性(idiopathic)」という)間質性肺炎(idiopathic interstitial pneumonias:IIPs,複数表記)が存在する(図7-5-2A).今回の改訂においては基本的に先の分類を踏襲し,後述するHRCT像を中心として,主間質性肺炎6種(IPF,iNSIP,RB-ILD,DIP,COP,AIP:略号は表7-5-1,7-5-2参照),希少間質性肺炎2種(iLIP,iPPF),分類不能間質性肺炎の大きな3系に分類された(表7-5-1,7-5-2).今改訂の特徴は臨床病態(clinical behavior)という分類が加味され,可逆的,可逆的だが進行もある,安定期,進行性で不可逆であるが安定も望める,治療にもかかわらず進行的で不可逆,の5病態に分け,治療目標も示された(表7-5-3).臨床的に重要なものは主要間質性肺炎であるが,後述するようにUIP,NSIP(NSIPは今改訂では暫定呼称ははずれ,組織像はuniform-appearanceと表記されている)の混在,あるいは膠原病の顕在化や慢性過敏性肺炎の鑑別など臨床経過観察が必要なものが分類不能間質性肺炎に入る.
(4)診断のアルゴリズム
前述したように,特発性肺線維症は,びまん性肺疾患のなかで,間質性肺炎の画像所見を示す原因の明らかな疾患を除外した,特発性間質性肺炎(複数)のなかで最も高頻度(約70%以上)の疾患である.その特徴的画像はHRCTで診断できるが,必要な場合は肺生検を行い,ほかの5種,ことにNSIPとの鑑別が重要である(その大分類は図7-5-2Aに,またアルゴリズムは図7-5-2B参照).現在,日本をはじめ多くの国では,本診断には,呼吸器臨床医のみならず,放射線診断医,病理診断医の参加による多分野専門医の診断体制(multi-disciplinary discussion:MDD)が推奨されている.
(5)肺線維化の関連遺伝子
他疾患にも共通するが疾患遺伝子同定は稀少な遺伝性疾患から始まる.アルビニズムに肺線維症が合併するHermansky-Pudlak症候群では1993年HPS-1遺伝子が同定された.その機能は細胞内顆粒の動態に関与するが,注目すべきはアルビニズムは出生時より明らかであるのに,肺線維化は40歳前後で顕在化する.すなわち単一遺伝子異常であっても,肺における線維症としての表現型の発現には加齢現象が関与する.一方小児領域の間質性肺炎は,サーファクタント蛋白やその分泌に関与する遺伝子異常が出生後早くより重篤な病態を惹起する(SP-C,SP-B,ABC-A3など).家族性間質性肺炎の罹患患者は同一家系非発症者に比べ,高齢・男性・喫煙者に多く,垂直伝播もみられるので,常染色体優性遺伝が疑われている.SNP microarrayを解析した報告では,第11染色体のMUC5B遺伝子近傍の関連が指摘されている.一方,再生不良性貧血にも関与が示唆されるテロメア短縮症候群にIPF症例がみられ,注目されている.
2)突発性肺線維症
概念
特発性肺線維症とは,原因不明の間質性肺炎のうち,病理組織的にはUIP(普通型間質性肺炎)を呈するもの(図7-5-2B)を指し,頻度は最も多い.加齢の影響下に,喫煙者に多く,自覚症状のない安定期を経て,咳,息切れなどの症状出現後は,平均余命が3~5年と予後不良である.近年,ようやく抗線維化薬の開発で進行抑制が期待されるようになった.
疫学・予後
本疾患は加齢が関与する点から,その頻度には調査時点での人口年齢構成が関与する.1980年頃の日本の調査では人口10万人あたり4人程度であったが,1993年の米国報告では人口10万人あたり約40人,現在日本では重症度Ⅲ,Ⅳについては臨床調査個人票の集計解析が可能となったが,実数はその10倍程度と予想される.実際,肺癌診断のHRCT検査では喫煙者に高頻度に間質性陰影をみる.患者は60~70歳代が約80%,男女比は約4:1で喫煙者の割合は80%以上(男性患者の大多数)である.喫煙者では気腫肺と一部の線維化肺が共存する肺気腫合併肺線維症(combined pulmonary fibrosis and emphysema:CPFE)が存在し,その解析が始まった. 健診による無症状発見例では10年以上の生存例もありうるが,咳などの自覚症状発症後は生存期間中央値が2~3年と肺癌に匹敵する予後不良な疾患である.呼吸困難は進行するが,%VCが60%を切ったり,PaO2が70 torr以下になると,冬季に急性増悪で死亡(全体の20~30%)したり,肺癌併発も多く(15~25%),気胸も重篤である.IPFの自然経過と,定型的な特発性肺線維症例の臨床経過を示す(図7-5-3A,B).
検査成績
1)問診による鑑別と機能,血液検査:
多くの患者は咳や息切れを自覚して受診したり,健診における胸部X写真異常影(両側びまん性,中下肺野,外側優位の線状影)で紹介される.ここで重要な点は詳細な問診である.鑑別すべき疾患は第一に職業・環境暴露であり,職歴(過去に遡って),吸入歴の聴取である.慢性過敏性肺炎として鳥飼病(広く鳥との接触や羽毛製品の使用も含めて聴取する)が注目されている.家族歴では膠原病性疾患の存在を確かめ,服用薬(漢方薬はいうに及ばず,最近では多用されるサプリメント使用なども)の詳細も重要な情報である.視診ではばち指を1/3程度の患者にみる.聴診上は特徴的なVelcroラ音とよばれる吸気終末のfine cracklesを背側肺底部に聴取する(約90%).近年気道上皮細胞,Ⅱ型肺胞上皮細胞由来のKL-6,SP-D,SP-Aなどが測定できる.これらは非特異的ではあるが,病勢推移などの参考になる血清マーカーであり,多くの例で高値となる.肺機能検査では拘束性変化として%VC低下,拡散能異常として%DLco低下や低酸素血症(PaO2低下,A-aDO2拡大,6分間歩行時SpO2低下)などが重要な診断所見である.
2)HRCT画像検査:
以上の過程でかなりの数の原因の明らかなびまん性肺疾患は除外しうるが,特発性間質性肺炎が疑われる場合,1~2 mmスライス厚の高解像度CT(high resolution CT:HRCT)撮影が必要である.IPFは,HRCTでUIPパターン(表7-5-4)を示し,その特徴は肺底部中心,末梢肺,胸膜近傍の線維性変化で蜂巣肺や牽引性気管支拡張像,部分的なすりガラス様陰影をみる.HRCT像で約90%が診断可能である.
3)侵襲的鑑別検査と肺生検:
HRCT像が典型的でない場合(たとえば上葉にも変化がみられる,気管支血管周囲陰影の増強,すりガラス様陰影や微小結節影が多いなど),侵襲の比較的少ない気管支鏡検査へ進む.しかしTBLB(transbronchial lung biopsy:経気管支肺生検)は特異な病理像(癌,肉芽腫,感染症など)を除いて,確定診断には使用できない(肺の炎症組織診断には数cm程度の大きさの,小葉サイズの検体が必要).一方,BAL(bronchoalveolar lavage:気管支肺胞洗浄)においては,リンパ球増加(アレルギー性機序),好酸球増加(アレルギー性機序),好中球増加(感染性機序)や肺胞蛋白症などは鑑別できる.特発性肺線維症は,BAL細胞分画上は特異的所見がない.しかしこれら侵襲の軽い検査でも急性増悪を惹起する場合もあるので,充分な説明と同意が必要である. これらの検査でも鑑別診断ができないとき,若年者,呼吸困難がない場合,暴露歴が判然としない場合など,胸腔鏡下肺生検を施行する.生検部位はHRCT像を参考に一葉以上で線維化の強い部分は避け,検体は適宜陰圧で肺胞腔を拡げる.特発性肺線維症に特徴的な所見はUIPであり,時相の均一でない斑状の病変で,蜂巣肺や線維芽細胞集簇などを多数みる(表7-5-5,表7-5-6).これら病理像は原因の明らかな間質性肺炎にもみられるので,病理診断名でなく全体像として例えばUIPパターンという表現をする(表7-5-6).
治療
特発性肺線維症の治療に関しては,共通認識としての治療マニュアルはあるが,EBMとしての治療はまだ十分でない.しかし今世紀初頭の国際共通分類を受け,インターフェロン-γ,ピルフェニドン,N-アセチルシステイン(NAC)などで多施設前向き二重盲検試験が実施され,現在もリン酸化酵素阻害薬などが進行中である.NACの経口錠剤やピルフェニドンの臨床試験で肺活量の低下が有意に抑制された.ピルフェニドンは日本,韓国,欧州各国で承認された. 現行の治療は安定期,不安定進行期,急性増悪期と分けて対応される.安定期には一般には経過観察のみで,NACが用いられる場合もある.咳,呼吸困難などの不安定進行期には,ピルフェニドン(600 mg/日からはじめ1800 mg/日で維持)が使用されるが,早期からの使用も考慮されている.労作時呼吸不全には酸素吸入(HOT)で対応する.注意すべきは,2011年,米国の臨床試験中間解析で,安定期には免疫抑制薬は使用すべきでないとの通達が米国食品医薬品局から出た.主として冬季,感染を契機とする急性増悪に対してはステロイド・パルス療法(メチルプレドニゾロン1 g/日,3日間),その後プレドニゾロン(1 mg/kg)で維持し,必要ならパルスを繰り返す.
3)非特異性間質性肺炎
概念・分類
非特異性間質性肺炎(NSIP)は,原因不明の間質性肺炎の総称「特発性間質性肺炎(idiopathic interstitial pneumonias:IIPs)」の一型である.確定診断には外科的肺生検に基づく病理診断が必須であるが,NSIPの特徴とされる組織パターンは,膠原病肺,過敏性肺炎,薬剤性肺炎,肺感染症,ARDS治癒期などの疾患・病態においてもみられるものであり,臨床像や検査所見によってこれらの疾患を除外しておくことが診断上重要である.また,NSIPと診断された後に皮膚・関節・筋症状が顕在化することがあり,そのような症例においては病名を膠原病肺へ変更する必要がある.NSIPは炎症と線維化の程度によって,細胞浸潤性非特異性間質性肺炎(cellular NSIP)と線維化性非特異性間質性肺炎(fibrotic NSIP)に亜分類される.NSIPの80%以上は線維化性NSIPである.亜型間で予後や薬剤治療の効果が異なり,線維化性NSIPは特発性肺線維症(idiopathic pulmonary fibrosis:IPF)に近い臨床経過を示す.
疫学
NSIPはIIPsのなかでIPFについで多く,日本での有病率は10万人対0.6であるが,外科的肺生検に基づく確定診断が得られていない「NSIP疑い例」はその数倍存在すると推定されている.平均年齢は50歳前後,3:7で女性に多い.IPFと異なり,非喫煙者が多い.
病理
病変部位の組織採取は外科的生検によることが必要である.経気管支肺生検(TBLB)では検体量が少なく診断には適さない.NSIPの主要な病理所見を通常型間質性肺炎(usual interstitial pneumonia:UIP)と対比し,表7-5-7に示す.NSIPの病理学的特徴を表すキーワードは,一様な病変分布と時相の一致,構造改変なし,リンパ球浸潤あり(細胞浸潤性NSIPで顕著),UIPより軽度の線維化形成あり(線維化性NSIP),ポリープ型腔内線維化あり,蜂巣肺形成なし(まれ<に顕微鏡的蜂巣肺あり),である.
臨床症状
発症様式は,亜急性(1~3カ月)とされてきたが,最近の報告ではむしろ慢性発症例が多い.乾性咳,労作時呼吸困難を認めることが多く,発熱はあっても軽度である.自覚症状がなく,健診や他疾患精査中に発見されることもしばしばである.大部分の症例で捻髪音を聴取する.ばち指の頻度はIPF患者よりも低く,陽性率が8~52%と報告によりさまざまである.膠原病に類似する症状を約10%の患者に認める.
検査成績
1)血液検査:
間質性肺疾患に共通した所見を呈する.亜急性発症例では,CRP上昇,赤沈亢進,白血球増加などの炎症所見を認めることもあるが,慢性発症例では異常値を示さない場合が多い.発症形式を問わず,間質性肺炎のバイオマーカーであるSP-A,SP-D,KL-6が高率に陽性となる.SP-AとSP-Dは細胞浸潤性NSIPと線維化性NSIPいずれにおいても同様に上昇するが,KL-6は線維化性NSIPにおいて,より高値を示す.進行例ではLDHが上昇する.各種自己抗体陽性例がみられ,膠原病肺との異同が論議されている.
2)呼吸機能検査:
拘束性換気障害(肺活量低下,全肺気量低下)と肺拡散能低下を認める.細胞浸潤性NSIPと軽症の線維化性NSIPでは,肺拡散能低下だけが有所見としてみられる場合がある.
3)胸部HRCT(図7-5-4):
ほかのIIPsとの鑑別の最初のステップとしてきわめて有用である.IPFとの共通点は病変が両側下肺野優位に分布することである.相違点は病変が胸膜から少し離れた部位を中心に分布していること,蜂巣肺所見に乏しいことの2点である.また,胸膜から5~10 mm内側に胸膜と並行して出現する “subpleural curvilinear shadow”はNSIPの特徴的所見である.牽引性気管支拡張(traction bronchiectasis)はIPFにもみられるが,線維化性NSIPにおいて変化がより顕著である.すりガラス様病変は特に細胞浸潤性NSIPにおいて顕著である.
4)BAL検査:
総細胞数の増加,特にリンパ球比率が増加する.細胞浸潤性NSIPではリンパ球比率が30%以上となり,CD4/CD8比が低下する場合が多い.線維化性NSIPでは総細胞数やリンパ球比率の増加は軽度であり,IPFに近い所見を呈する.
診断
「病理所見がNSIPパターンであること」が臨床診断にとって必須事項であるが,同様の病理所見を呈する既知の疾患を鑑別除外した後に確定診断が成立する.詳細は「特発性間質性肺炎—診断と治療法の手引き(2011)」の診断フローに示されている.
鑑別診断
膠原病肺,過敏性肺炎,薬剤性肺炎,肺感染症,ARDS治癒期,IPFや特発性器質化肺炎(cryptogenic organizing pneumonia:COP)などのNSIP以外のIIPsが鑑別すべき疾患である.膠原病肺の画像および病理所見は多彩であり,NSIPと共通した所見を呈する場合も多く,胸膜病変の存在とリンパ濾胞が発達している点が診断のポイントとされる.細胞浸潤性NSIPと急性型過敏性肺炎,線維化性NSIPと慢性型過敏性肺炎が鑑別上重要である.肉芽腫の存在が決め手となる.
合併症
進行例では慢性呼吸不全と肺高血圧症を伴う.ステロイドや免疫抑制薬の使用に伴い種々の合併症が出現する.
経過・予後
NSIPは5年生存率82%,10年生存率73%と予後良好の疾患とされる.しかし,線維化性NSIPに限っていえばIPFと同様に予後不良である.
治療
(図7-5-5) 細胞浸潤性NSIPに対してはステロイド単独療法を行う.治療効果は比較的良好である.一方,線維化性NSIPではステロイド単独の効果は低く免疫抑制薬(シクロスポリンなど)を併用する.ただし,高いエビデンスは得られていないため,臨床経過と想定される有害事象とのバランスを考慮したうえで治療の可否と薬剤選択を決定する.
4)特発性器質化肺炎
定義・概念
1983年Davisonらにより最初に報告された臨床病理学的疾患概念であり,病理学的に肺胞囊から肺胞管内の器質化病変(肉芽)を特徴とする原因不明の肺炎である.形成される肉芽はポリープ様で,しばしば終末~呼吸細気管支に広がり閉塞性細気管支炎を伴うことから,1985年EplerらはBOOP(bronchiolitis obliterans organizing pneumonia)として体系的に報告したが,2002年のATS/ERS international consensus statementにおいて,特発性間質性肺炎(idiopathic interstitial pneumonias:IIPs)の1つの疾患概念として整理され,COPという名称に統一された.
疫学
COPは,50~60歳代に発症し,男女差はなく,喫煙との関連もないとされている.
臨床所見
症状発現から受診までの期間は比較的短く,3/4の症例で2カ月未満である.臨床的に発熱を伴うことが多く,乾性咳,労作時呼吸困難,食欲不振,体重減少や筋肉痛を認める.血痰,胸痛,寝汗,気胸,関節痛はまれである.身体所見では,しばしば吸気時の捻髪音を聴取するが,ばち指は認めない.また身体所見上,異常を認めないことも多い(25~50%).
検査成績
1)血液検査:
赤沈亢進,CRP上昇,好中球増加を認めることが多い.間質性肺炎マーカーであるKL-6は上昇しにくいが,SP-A,SP-Dは上昇することが多い.
2)呼吸機能:
拘束性換気障害,拡散能の低下,安静時あるいは労作時低酸素血症がみられる.
3)気管支肺胞洗浄:
総細胞数とリンパ球の増加を認める.一般にリンパ球は20~40%,好中球:~10%,好酸球:~5%で,形質細胞やマスト細胞の存在は,COPで目立つ所見である.リンパ球のCD4/CD8比は低下することが多い.
画像所見(図7-5-6,7-5-7)
典型的な胸部X線写真およびHRCTパターンは,斑状の気管支透亮像(air bronchogram)を伴う多発性浸潤影で,両側性,末梢性でしばしば移動性を認める(10~50%).頻度は少ないが,単発の結節影や網状影を示すことがある.
病理(図7-5-8)
主要所見は,①肺胞囊~肺胞管にかけての器質化所見(肉芽),②終末細気管支~呼吸細気管支にかけての肉芽による閉塞,③リンパ球を中心とした胞隔炎である.病変の時相は均一で斑状に分布し,肺胞構造は保たれる.蜂巣肺や硝子膜はみられない.
鑑別診断
臨床所見と画像所見から,多くの患者は肺炎としてまず抗菌薬の投与を受けていることが多く,その後,抗菌薬不応性の肺炎として精査が行われる. 通常,気管支鏡下に気管支肺胞洗浄を行い,経気管支肺生検(transbronchial lung biopsy:TBLB)を行う.特徴的な病理所見が得られれば,COPはTBLBと臨床所見から診断可能である. 病理組織学的に,器質化肺炎パターンを示す疾患は多彩(表7-5-8)で,これらを鑑別することが必要である.たとえば一般細菌,ウイルス,真菌などの感染症,膠原病や薬剤性肺炎を除外する必要がある.乳癌治療目的に行われた放射線照射後に,COP様の病変が出現することがあり,注目されている.IIPsの中では,cellular NSIPとの鑑別が重要であり,また好酸球性肺炎とは鑑別が難しいケースがある.
治療
ステロイドの反応は良好である.通常プレドニゾロン0.5~1 mg/kg/日の経口投与で開始し,1~2カ月投与後,漸減する.80%以上の症例で改善がみられる.再発率は高いが(~58%),再発しても治療に対する反応性は良好で予後は良好である.難治例には免疫抑制薬が使用される場合もある.
5)放射線肺臓炎
定義・概念
放射線肺臓炎は,胸部放射線照射によって発生する間質性肺炎で,放射線治療中または終了後に発生する間質性肺炎である.そして慢性的なもの(照射後6カ月経過)を放射線肺線維症(radiation pulmonary fibrosis)という.照射対象となる疾患は肺癌,乳癌,食道癌,悪性リンパ腫である.
疫学
放射線肺臓炎の発症頻度は,放射線治療法,線量,放射線治療の既往,抗癌薬や分子標的薬の併用,基礎疾患などによって異なる.自覚症状を伴うものは約8%との報告があるが,無症状の画像変化は40~50%に認められる.胸部CTでみると30Gy以上の照射で70%の発生率がある.総線量の増加に伴い発症時期は早まるが,分割照射の方が発生率は少ない.化学療法との併用で発生率が高くなる(Davisら,1992).
病因・病態発生
電離放射線(ionizing radiation)によって生じたOH−がフリーラジカルとなって組織を破壊する.特にⅡ型肺胞上皮細胞と血管内皮細胞は放射線感受性が高く,傷害を受けやすいとされている.直接の組織傷害のほかに宿主の反応が免疫担当細胞を活性化し,間接的に組織傷害を引き起こすと考えられる.すなわちTNF-α(腫瘍壊死性因子),IL-1,IL-6などの炎症性サイトカインの増加も病態に関与しているといわれている.放射線肺障害の原因として,放射線を肺に照射するとTNF-α,IL-1,IL-6などのサイトカインが上昇することは実験的に証明されている.これらのサイトカインの上昇が好中球を活性し,活性化した好中球の肺への集積,エラスターゼの放出,肺血管内皮障害,肺血管上皮傷害を順に引き起こして肺障害を起こす. 一度Ⅱ型肺胞上皮が傷害を受けると,一時的にはサーファクタントが放出される.しかし次第にサーファクタントが欠乏して虚脱肺が形成される.照射後から数カ月経過すると肺胞壁は肥厚し全体的に線維化が進行する.また,照射外に起こる傷害(照射外の肺野に広がる散発性放射線肺臓炎や乳癌照射後の器質化肺炎(organizing pneumonia))はBAL中にTリンパ球が増加している所見から,おもに免疫的機序が関与していると考えられる(Martinら,1999).
臨床症状
画像所見を認めても多くは無症状のことが多いが,乾性咳や微熱も比較的早期から出現することもある.多くは照射終了後2~6カ月後に発症することがあるが,照射中に発症し,照射を断念せざるを得なくなることも少なくない.本疾患の症状によるRTOG/EORTCの重症度分類がある(表7-5-9).
身体所見
聴診にて病変部に一致して吸気終末のcracklesを聴取するが,範囲が狭ければ無所見のことが多い.
1)検査:
a)胸部X線:胸部単純X線で,急性期は異常所見を呈さないことが多い.照射領域に一致した肺野にすりガラス様陰影,斑状陰影を呈する.区域性や肺葉に一致しない.また化学療法併用時は薬剤性肺障害との鑑別が非常に難しい.慢性化すると肺線維化が進み,収縮性変化を伴う肺胞性陰影(consolidation)を呈する.
b)胸部CT:照射方向,領域に一致した直線状の境界を示す病変を呈する(図7-5-9).病変は区域や肺葉に一致しない.またときに照射外に病変が及ぶことがある.縦隔照射によるリンパ管閉塞,照射範囲外の肺への放射線の吸収,炎症部位からのサイトカインの放出,放射線照射による器質化肺炎などの病態が考えられている.
c)血液検査:白血球増加,CRP上昇,赤沈亢進,KL-6(シアル化糖鎖抗原),SP-A(サーファクタント蛋白A),SP-D(サーファクタント蛋白D)の上昇をみる.最近の肺病変の範囲,活動性と血清KL-6値の関係についての検討では,照射野外に及ぶものは照射内に限局するものより高値を示し,陳旧性のものは活動性のものより低値を呈する傾向がある(Gotoら,2001).
2)血液ガス:
障害の程度に応じてPaO2,PaCO2,A-aDO2の開大を認める.また6分間歩行などの運動負荷による低酸素血症は比較的早期の段階で認められる.
3)呼吸機能検査:
障害の程度により肺活量の低下(拘束性障害),拡散能の低下を認める.
DLCOの低下が感度の高い呼吸機能障害である.
4)合併症:
a)ARDS(急性呼吸促迫症候群):重症例では細菌感染なども合併し,重篤化することがある.
b)慢性呼吸不全から右心不全:広範囲の肺線維症では慢性呼吸不全から右心不全を呈することがあり,チアノーゼ,頸静脈怒張,浮腫,肝腫脹を認めることがある.
c)薬剤性肺障害の助長:アクチノマイシンD,アドリアマイシン,ブレオマイシン,ゲムシタビン,ゲフィチニブなどの投与は薬剤性肺炎の危険度が増す(表7-5-10).
また放射線照射から長時間経過した後に薬剤投与によって誘発されるリコール現象にも注意する(Schweizer ら,1995).
鑑別診断
腫瘍再燃の際の鑑別は難しいことが多い.最近,慢性閉塞性肺疾患や間質性肺疾患などの低肺機能に合併した手術不能な末梢孤立性肺癌症例では,定位放射線療法が行われるようになった.しかし本療法においても肺臓炎が発症することもあり,従来の放射線療法に比べ腫瘍再燃の鑑別は難しいとされている(表7-5-11).また癌性リンパ管症では,気管支血管束の肥厚や小葉間隔壁の肥厚が認められ,画像上の鑑別になり得る.基本的には造影CTやFDG-PETに加え腫瘍マーカーを用いての総合的診断を行う.また呼吸器感染症では痰の培養検査,陰影が区域性かどうかも鑑別になりうる.ニューモシスチス肺炎ではβ-d-グルカンの上昇や誘発喀痰によるPCR法による確認が有用である.場合によっては気管支鏡検査による組織学的診断が必要になる.また薬剤性肺炎,既存の特発性肺線維症の急性増悪などの鑑別は必要だが,難しいことも多い.
治療
1)予防:
健常肺組織への線量軽減をはかるために三次元的な線量分布を常に検討することが推奨されている.最近では線量-体積ヒストグラム(dose-volume-histogram)を用いて有害事象の予測を行っている.化学療法同時併用ではV20(20 Gy以上被照射体積の割合)を25~30%以下にすることで発症が軽減されるようである. また危険因子(表7-5-10)を背景にもつ症例では十分な治療法の検討や経過観察を行う.定期的な胸部CTの撮影は有用である.
2)治療:
発症した際の,確立した治療法はない.速やかに放射線治療を中止にする必要がある.軽症例は経過観察で改善することが多い.しかし呼吸困難を呈する症例,低酸素血症をきたす症例,進行的に照射外に広がる症例では一般的にはプレドニゾロン40〜60 mg/日を投与する.数週かけてゆっくり減量していく.また重症例や治療抵抗例ではステロイドパルス療法(メチルプレドニゾロン1 g/日,3日間)や免疫抑制薬(アザチオプリン,シクロスポリン)の投与が行われる.乳癌照射後の器質化肺炎ではステロイドが著効する.
6)薬剤性肺炎
定義・概念
薬剤に起因する肺炎である.市販薬や健康食品を含めたすべての薬剤が起こしうると考えた方がよい.それを予知し回避することは困難であること,薬剤によっては日本人に重篤な薬剤性肺炎が発生しやすいことから,社会問題にもなっている.
分類・病因
表7-5-12に薬剤による肺病変の分類を示す.多彩であるが,頻度的に薬剤性間質性肺炎が重要であり,特発性間質性肺炎に準じて分類する.
病態生理
抗癌薬など毒性をもつ薬剤は細胞傷害や遺伝子障害を,ほかの薬剤では直接あるいは反応性の中間代謝産物により過敏反応を引き起こすことが多い.その他,薬剤誘起性ループス,薬剤性血管炎に基づく肺障害がある.
臨床症状
発熱,咳,呼吸困難などの呼吸器症状を呈する.喘鳴,胸痛あるいは血痰を呈することもある.背側胸部のラ音(捻髪音)が初期指標となることがある.
検査成績
薬剤性肺障害の診断チャートを図7-5-10に示す.HRCT画像のパターンは必ずしも病理像と一致しないが,画像から診断名を推定することが多い.死亡例はびまん性肺胞傷害や線維化を伴う間質性肺炎に多く,血清KL-6,サーファクタント蛋白Dはこのようなより重症の肺障害で上昇することが多い.薬剤リンパ球刺激試験はあまり有用ではないが,ときに原因薬剤推定の参考になることがある.
診断・鑑別診断
新たな肺炎が薬剤と関連して発生し,ほかの原因を除外できれば薬剤性肺炎と診断できる.しかし,実臨床では確定診断できるものはむしろ少なく,疑診にとどまることが多い.
図7-5-10に示すように,日和見感染や原疾患の増悪との鑑別が重要である.
治療・予防
薬剤性肺炎が疑われれば,原則として直ちに原因と考えられる薬剤を中止する.低酸素血症を認める場合は酸素投与に加えステロイド治療を行う.
禁忌
既存の間質性肺炎を有する場合,一部の抗癌薬・インターフェロンは投与禁忌である.
特殊な薬剤性肺炎
1)パラコート肺(paraquat lung):
パラコートは致死率が高く解毒剤もないため,自殺や他殺に使用され問題になった農薬である.服毒すると嘔吐や喉の痛み,ショック,その後肝腎機能障害を経て,急性呼吸促迫症候群類似のパラコート肺(肺線維症)へと進み死に至る.
2)リポイド肺炎:
外因性リポイド肺炎は誤嚥された油類を含む薬剤などにより生じる.病理学的には異物巨細胞を含む炎症反応である.内因性のものは,肺癌や異物により閉塞が生じた末梢側に組織の分解により生じた脂肪を含む泡沫化マクロファージが存在する.
7)ガス・粉じんによる肺疾患
有機の化学物質や粉じんは,免疫反応により過敏性肺炎や気管支喘息,無機粉じんはじん肺(pneumoconiosis)の原因となる.これらの疾患では,詳細な職歴聴取が重要である.
(1)珪肺症(silicosis)
原因・病理
トンネル工事,採掘・採石,研磨,鋳造など,シリカ(ケイ酸)への職業性暴露により生じる.同心円状のコラーゲン層状構造を示す珪肺結節(silicotic nodule)を形成し,これが癒合すると進行性塊状線維症(progressive massive fibrosis:PMF)とよばれる病変を生じる.大量の急性暴露は肺胞蛋白症に類似した病態を呈する.
病態生理
肺胞マクロファージがシリカを貪食し活性化され,炎症性サイトカイン(TNF-αやIL-1など)やオキシダントを産生し,組織障害・炎症を生じる.
臨床症状
広範な陰影があっても初期は自他覚症状がないことが多い.進行すれば労作時呼吸困難(拘束性および閉塞性換気障害)を生じ,続発性気管支炎を伴えば咳・痰を伴う.肺胞マクロファージの機能障害により結核などが,シリカの発癌性により肺癌を合併し得る.末期には肺性心から右心不全に進行する.
診断・鑑別診断
粒状影が特徴で,表7-5-13のように分類する.進行すれば非区域性の塊状影を呈する(大陰影:図7-5-11A).肺門リンパ節の卵殻状石灰化(eggshell calcification)は特徴的所見である.
治療
対症的治療を行う.さらなる暴露がなくても線維化は進行し得る.
(2)石綿関連肺疾患
石綿暴露は石綿の採掘・加工のほか,造船,配管,ボイラー業務と関連する.平成18年より石綿の輸入や使用が全面禁止された.
1)石綿肺(asbestosis):
比較的大量の暴露により生じるびまん性の肺線維化で,特発性肺線維症に類似する.
2)胸膜プラーク(肥厚斑:図7-5-11B):
石灰化を伴うこともある.石綿への暴露歴を表す.
3)肺癌:
石綿による悪性腫瘍の中で肺癌は最も頻度が高い.喫煙と石綿には相乗的にリスクを上昇させる.胸膜プラークが存在すれば,あるいは肺内の石綿線維・石綿小体数が多ければ石綿が原因と判断する.
4)中皮腫:
石綿が原因であり,比較的短期の暴露であっても生じ得る.
5)びまん性胸膜肥厚:
臓側・壁側胸膜がともに線維化をきたし癒着するため,拘束性障害を呈する.
6)良性胸水:
発症機序は不明である.血性の場合もある.
7)円形無気肺:
石綿症に特異的ではないが,しばしば認められる.
(3)その他のじん肺
1)炭坑夫肺(coal worker’s pneumoconiosis):
珪肺症に類似する.リウマチ因子陽性でじん肺結節を呈するCaplan症候群は,炭粉に併存するシリカの免疫アジュバント作用によると考えられる.
2)ベリリウム(Be)肺:
急性肺炎のほか,慢性的にはサルコイドーシスに類似した慢性肉芽腫性肺疾患をきたす.Beに対する遅延型過敏反応を認める.
(4)その他
戦時中,わが国でもイペリットなどの毒ガスの製造が行われ,従事者の急性の呼吸器障害が知られており,慢性期ではCOPDや肺癌の合併が問題となっている.
大気汚染は気管支喘息や肺癌の発症に関与する.二酸化硫黄,窒素酸化物,オゾンなどが問題であり,環境濃度基準が設けられている.
室内におけるダニなど環境アレルゲンが喘息の原因となる.また,バイオマス燃料により生じた粒子状物質への暴露は世界的には大きなCOPDの原因となっている.[貫和敏博・高橋弘毅・西岡安彦・野呂林太郎・吾妻安良太・横山彰仁]
■文献
Raghu G, et al: An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med, 183: 788-824, 2011.
Travis WD, et al: An official ATS/ERS statement: Update of the international multidisciplinary consensus classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med, 2013, in press.
日本呼吸器学会びまん性肺疾患診断・治療ガイドライン作成委員会:特発性間質性肺炎 診断と治療の手引き,改訂第2版,南江堂,東京,2011.
American Thoracic Society/European Respiratory Society International Multidiciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias. Am J Respir Crit Care Med, 165:277-304, 2002.
日本呼吸器学会びまん性肺疾患診断・治療ガイドライン作成委員会編集:特発性間質性肺炎—診断と治療法の手引き,改訂第2版,南江堂,東京,2011.
Travis WD, Hunninghake G, et al: Idiopathic nonspecific interstitial pneumonia: report of an American Thoracic Society project. Am J Respir Crit Care Med, 177: 1338-1347, 2008.
American Thoracic Society/European Respiratory Society International Multidisciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias. Am J Respir Crit Care Med, 165: 277-304, 2002.
Cordier J-F: Cryptogenic organizing pneumonia. Eur Repir J, 28: 422-446, 2006.
Epler GR, Colby TV et al: Bronchiolitis obliterans organizing pneumonia. N Engl J Med, 312: 152-158, 1985.
Davis SD, Yankelevitz DF, et al: Radiation effects on the lung: clinical features. Pathology, and Imaging Findings, 159: 1157-1164, 1992.
Goto K: Serum levels of KL-6 are useful biomarkers for sevear radiation pneumonitis. Lung Cancer, 34: 141-148, 2001.
Martin C, et al.: Bilateral lymphocytic alveolitis: a common reaction after unilateral thoracic irradiation. Eur Respir L, 13: 727-732, 1999.
Schweizer VG, et al: Radiation recall dermatitis and pneumonitis in a patient treated with paclitaxel. Cancer, 76: 1069-1072, 1995.
日本呼吸器学会薬剤性肺障害ガイドライン作成委員会:薬剤性肺障害の評価,治療についてのガイドライン,メディカルビュー社,東京,2006.
横山彰仁:薬剤性肺疾患 診断へのアプローチ,日内会誌96: 1097-1103, 2007.
労働省安全衛生部労働衛生課編:じん肺診査ハンドブック,改訂版,中央労働災害防止協会,東京,1979.
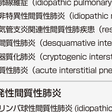
表7-5-1

表7-5-2

表7-5-3

表7-5-4

表7-5-5
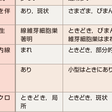
表7-5-6
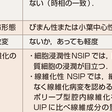
表7-5-7

表7-5-8

表7-5-9
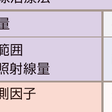
表7-5-10
表7-5-11

表7-5-12
表7-5-13
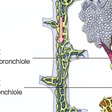
図7-5-1
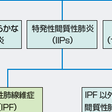
図7-5-2
図7-5-3A

図7-5-5
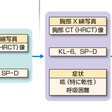
図7-5-10
出典 内科学 第10版内科学 第10版について 情報
