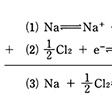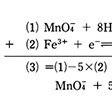翻訳|oxidation
精選版 日本国語大辞典 「酸化」の意味・読み・例文・類語
さん‐か ‥クヮ【酸化】
出典 精選版 日本国語大辞典精選版 日本国語大辞典について 情報
日本大百科全書(ニッポニカ) 「酸化」の意味・わかりやすい解説
酸化
さんか
oxidation
oxidization
単体が酸素と化合する化学現象を酸化と定義したのはフランスのラボアジエであったが、原子の電子構造と化学的性質との関係が明らかになるにつれて意味が変わり、現在では、原子・分子・イオンなどが電子を放出することを酸化としている。放出された電子は、別の原子・分子・イオンに受け取られることになるが、電子を受け取る現象が還元であり、一般に酸化と還元はかならず相補的に随伴しておこり、その化学反応を酸化還元反応という。
酸化・還元は、酸・塩基とともに化学反応の理解にはきわめて重要な概念となっている。デンマークのブレンステッドの酸塩基理論が、共役する酸と塩基との間の水素イオンの移動を基本としているのに似て、酸化・還元では共役する酸化体oxidantと還元体reductantとの間の電子の移動が基本になる。
ナトリウムと塩素から塩化ナトリウムを生ずる反応をに示す。反応式(3)は、ナトリウム原子が電子を放出する反応(1)と、塩素分子が電子を受け取る反応(2)の和の結果とみることができる。
ここで(1)と(2)は、酸化体と還元体との電子の移動を介した共役関係を示しており、一般に
酸化体+電子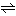 還元体
還元体
の形の式で書かれる。この形の式を半反応式という。酸化還元反応式は、二つの半反応式を組み合わせた形になるが、水素イオン、水酸化物イオン、水などがこれに加わる場合もよくみられる。たとえば過マンガン酸イオンと鉄(Ⅱ)イオンとの酸化還元反応はのように書かれる。
[岩本振武]
酸化剤と還元剤
電子を受け取って還元体になりやすい酸化体を酸化剤、電子を放出して酸化体になりやすい還元体を還元剤というが、それらは絶対的に定まるのではなく、互いの組合せによって相対的に定まる。たとえば、過酸化水素は過マンガン酸イオンに対しては還元剤として、ヨウ化物イオンに対しては酸化剤として作用する。
5H2O2+2MnO4-+6H+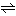 5O2+2Mn2++8H2O
5O2+2Mn2++8H2O
H2O2+2I-+2H+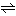 I2+2H2O
I2+2H2O
酸化剤あるいは還元剤の相対的強さは、それぞれの半反応における酸化還元電位の相対的差によって定まる。また、原子・分子・イオンなどにおける電子の出入りはそれらの酸化数に変化を生じ、酸化数が増大することを酸化、減少することを還元と定義することもできる。
[岩本振武]
酸化還元反応の例
酸化還元反応の例は多く、呼吸、燃焼、爆発などは、酸素が関与するものの典型例である。電池反応の多くは、自動的に進行する酸化還元反応を利用して、その反応による自由エネルギーの変化を電流として外部に取り出すものであり、電気分解反応では逆に電流を加えて自動的に進行する酸化還元反応を逆行させている。大気汚染公害で俗にオキシダントとよばれている物質は、窒素や硫黄(いおう)の酸化物(酸化体)あるいはそれによって生じた別の酸化体である。
[岩本振武]
『守永健一著『酸化と還元』(1972・裳華房)』▽『曽根興三著『酸化と還元』(1978・培風館)』
百科事典マイペディア 「酸化」の意味・わかりやすい解説
酸化【さんか】
→関連項目還元剤|酸化剤|全層施肥|脱色剤
出典 株式会社平凡社百科事典マイペディアについて 情報
知恵蔵 「酸化」の解説
酸化
(市村禎二郎 東京工業大学教授 / 2007年)
出典 (株)朝日新聞出版発行「知恵蔵」知恵蔵について 情報
ブリタニカ国際大百科事典 小項目事典 「酸化」の意味・わかりやすい解説
酸化
さんか
oxidation
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
改訂新版 世界大百科事典 「酸化」の意味・わかりやすい解説
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
栄養・生化学辞典 「酸化」の解説
酸化
化学辞典 第2版 「酸化」の解説
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
世界大百科事典(旧版)内の酸化の言及
【酸化・還元】より
…狭義の定義として,物質が酸素と結合することを酸化oxidationといい,酸化物が酸素を失うことを還元reductionという。たとえば,銅Cuを空気中で加熱すると, 2Cu+O2―→2CuOの反応をして酸化銅CuOとなる。…
※「酸化」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
今日のキーワード
焦土作戦
敵対的買収に対する防衛策のひとつ。買収対象となった企業が、重要な資産や事業部門を手放し、買収者にとっての成果を事前に減じ、魅力を失わせる方法である。侵入してきた外敵に武器や食料を与えないように、事前に...
お知らせ
4/12 日本大百科全書(ニッポニカ)を更新
4/12 デジタル大辞泉を更新
4/12 デジタル大辞泉プラスを更新
3/11 日本大百科全書(ニッポニカ)を更新
2/13 日本大百科全書(ニッポニカ)を更新