精選版 日本国語大辞典 「炭酸」の意味・読み・例文・類語
たん‐さん【炭酸】
出典 精選版 日本国語大辞典精選版 日本国語大辞典について 情報
出典 精選版 日本国語大辞典精選版 日本国語大辞典について 情報
化学式H2CO3。二酸化炭素の水溶液中にのみ存在しうる二塩基酸で,気相中の二酸化炭素とはつぎの平衡を保つ。
CO2(気)+H2O=H2CO3*
ただし[H2CO3*]=[CO2(水溶液)]+[H2CO3],電離定数K′=3.47×10⁻2mol/dm3・atm(25℃)。温度が上昇すると平衡は左へ偏り,二酸化炭素の溶解度が減少する。溶液中に生成した炭酸はつぎのように解離する(無限希薄溶液,25℃。以下同様)。
H2CO3=H⁺+HCO3⁻ (K1=1.74×10⁻4mol/dm3)
HCO3⁻=H⁺+CO32⁻ (K2=4.68×10⁻11mol/dm3)
水に溶解している二酸化炭素の全量[H2CO3*]に対する解離平衡定数はつぎのようである。
H2CO3*=H⁺+HCO3⁻ (K1′=4.47×10⁻7mol/dm3)
また溶液中に生成する炭酸と液相中の二酸化炭素との平衡定数はつぎのように算定されている。
H2CO3=H2O+CO2 (K″=2.57×10⁻3mol/dm3)
液相中における炭酸と二酸化炭素との平衡は比較的遅く進行する。
多くの炭酸塩が知られており,一般に,金属の酸化物あるいは水酸化物に二酸化炭素を反応させるか,所要の金属塩水溶液に炭酸アルカリないしは炭酸水素アルカリ水溶液を反応させてつくられる。遷移金属の塩は多く着色しているが,それ以外の塩はすべて無色である。アルカリ金属の塩は一般に水によく溶けるが,リチウム塩の炭酸リチウムLi2CO3のみは例外で,比較的難溶であり,しかも温度上昇とともに溶解度が減少する。また炭酸タリウムTl2CO3もわずかに溶けるが,それ以外の炭酸塩はすべて水に難溶である。アルカリ土類金属塩は難溶ではあるが,二酸化炭素水溶液には炭酸水素塩をつくって溶ける。炭酸水素塩は古く重炭酸塩と誤称されていた。アルカリ金属の炭酸塩は強熱しても融解するだけで,それ以外の塩は一般に分解して二酸化炭素を発生し,酸化物となる。遷移金属を含めて多くの重金属の塩の水溶液に,炭酸アルカリ水溶液を反応させても炭酸塩は得られず,一般に複雑な塩基性炭酸塩となる。たとえば塩化コバルト(Ⅱ)水溶液に炭酸カリウムを加えると2CoCO3・3Co(OH)2・H2Oのような組成の塩が得られる。正塩は,たとえば二酸化炭素を飽和させた炭酸水素ナトリウム水溶液を作用させるなどして得られる。水に不溶の炭酸塩でも酸には二酸化炭素を発生して分解して溶ける。
執筆者:大瀧 仁志
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
二酸化炭素が水に溶けて生じる酸。化学式H2CO3、式量62.03。水溶液としてだけ知られている。25℃、1気圧で二酸化炭素が水に溶けると0.033モル溶液が得られ、そのpHは4ぐらいとなる。これは、溶けた二酸化炭素が水溶液中で次の平衡により、炭酸という弱酸を生じたためである。
CO2+H2O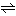 H2CO3
H2CO3
普通は、溶けた二酸化炭素がすべて炭酸の分子H2CO3を生じ、これが弱い二塩基酸として次のような二段の電離をしているものと考えられている。
H2CO3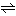 H++HCO3-
H++HCO3-
K1=4.16×10-7
HCO3-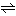 H++CO32-
H++CO32-
K2=4.84×10-11
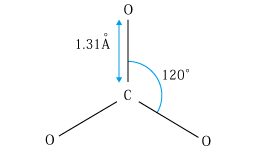
ここでK1は第一電離定数、K2は第二電離定数。しかし、実際は溶けた二酸化炭素の1%足らずがH2CO3を生じているにすぎず、大部分は弱く水和したCO2として存在している。したがって、溶けたCO2が100%H2CO3となり、これが電離して水素イオンを生じたものとして求めた先の平衡定数は、炭酸の真の電離定数とは考えられない。溶けたCO2の1%足らずがH2CO3となり、これが電離したものとして求めたK1の値は約2×10-4となり、炭酸が本当は酢酸よりむしろ強い酸ということになる。さらに、二酸化炭素が水に溶けて水和の平衡に達する速度が遅いことが知られている。炭酸イオンCO32-は炭素原子を中心とする正三角形の平面構造をしている。
数気圧で二酸化炭素を飽和させた水、すなわち炭酸水はソーダ水とよばれ、清涼飲料としての歴史は古い。
[守永健一]
H2CO3(62.03).二酸化炭素の水溶液は次のような平衡により炭酸を生成する.
CO2 + H2O  H2CO3
H2CO3
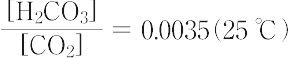
この平衡に達する速度は遅い.熱すれば平衡は左に移動し,炭酸は二酸化炭素を発生して分解するため,炭酸を遊離の形で得ることはできない.しかし,炭酸が二塩基酸であることに相当して,多くの酸性および中性の塩が知られている.酸電離定数,
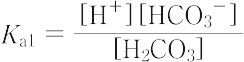
は1.3×10-4(25 ℃)であるが,通常の酸塩基平衡の計算には,
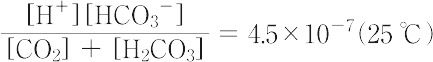
が用いられる.
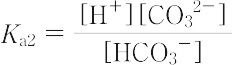
は4.7×10-11(25 ℃)である.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
出典 株式会社平凡社百科事典マイペディアについて 情報
血液中の脂質(トリグリセリド、コレステロールなど)濃度が基準値の範囲内にない状態(脂質異常症)に対し用いられる薬剤。スタチン(HMG-CoA還元酵素阻害薬)、PCSK9阻害薬、MTP阻害薬、レジン(陰...
4/12 日本大百科全書(ニッポニカ)を更新
4/12 デジタル大辞泉を更新
4/12 デジタル大辞泉プラスを更新
3/11 日本大百科全書(ニッポニカ)を更新
2/13 日本大百科全書(ニッポニカ)を更新