内科学 第10版 の解説
悪性腫瘍に伴う高カルシウム血症(副甲状腺・カルシトニン・ビタミンD)
悪性腫瘍患者に合併するいわゆる腫瘍随伴症候群(paraneoplastic syndrome)の代表的な症候である.
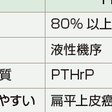
分類(表12-5-12)
大多数が,腫瘍が産生する全身性ホルモン様因子によって起こり,HHM(humoral hypercalcemia of malignancy)とよばれる.局所因子を介するLOH(local osteolytic hypercalcemia)の場合もある.
病因
HHMは大部分の場合,腫瘍細胞が産生する副甲状腺ホルモン関連ペプチドPTHrP(parathyroid hormone-related peptide)によって高カルシウム血症が起こる.
LOHは,多発性骨髄腫や乳癌などの広範な骨転移例において認められる.前者では,骨髄腫細胞が産生するリンホトキシン(lymphotoxin)やインターロイキン(IL-1,IL-6)が局所で骨吸収を刺激する.乳癌では,全身性の高PTHrP血症がなくても,骨に転移した癌細胞が産生するPTHrPが局所で骨吸収を促進する場合がある.
疫学
悪性腫瘍患者に高カルシウム血症が合併する頻度は10〜20%程度で,多くは進行期にみられる.
病理
HHMを起こす悪性腫瘍は,扁平上皮癌(肺・皮膚・頭頸部など)が最も多い(表12-5-12).わが国の西南地方に多発する成人T細胞リンパ腫・白血病も高頻度でPTHrPを過剰産生しHHMを合併する.良性の褐色細胞腫もHHMを起こすことがある.
病態生理
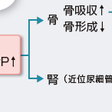
PTHの生物活性にはアミノ末端の34残基が重要であるが,141個のアミノ酸からなるPTHrPは,アミノ末端の13残基中6個がPTHと同一であり,PTHときわめて類似の生物作用を発揮する(図12-5-18).腫瘍細胞から過剰に産生・分泌されたPTHrPは,全身の血液中を循環し,腎尿細管および骨芽細胞表面に存在するPTHとPTHrPに共通の受容体(PTH/PTHrP受容体)と結合する.骨では,骨芽細胞への作用を介して間接的に破骨細胞による骨吸収を促進し,骨のミネラル成分であるヒドロキシアパタイト[Ca10(OH)2(PO4)6]を溶解する結果,血液中にCa2+,OH−,PO43−が動員されることになる.PTHrPは,腎の遠位尿細管でCaの再吸収を促進し,骨からのCa動員との総合作用で高カルシウム血症をもたらす(図12-5-18).高カルシウム血症によるフィードバック抑制により,血中PTHは低値を示す.
PTHrPはPTHと同じく,近位尿細管において,サイクリックAMP(cAMP)をセカンドメッセンジャーとして,PO43−の再吸収閾値(TmP/GFR)の低下を介してPの再吸収を抑制(排泄を促進)する.骨からPO43−が動員されるが,PTH過剰症である原発性副甲状腺機能亢進症と同じく,腎作用の結果として低リン血症になる.
臨床症状
①原因となる悪性腫瘍による症状,②高カルシウム血症に起因する症状,③その他のサイトカインによる症状に分けられる.高カルシウム血症は,尿濃縮能障害から多尿・脱水・口渇,腎機能障害,食欲不振・悪心・嘔吐・便秘などの消化器症状,ときに意識障害をもたらす.慢性のPTH過剰症である原発性副甲状腺機能亢進症と異なり,悪性腫瘍に伴う高カルシウム血症は一般的に急速進行性である.高カルシウム血症に特異的な症状はなく,まったく無症状のことも多いので,疑いのある場合は血清Caのチェックが重要である. 癌細胞はPTHrPばかりでなくその他のホルモンや,顆粒球コロニー刺激因子(granulocyte colony-stimulating factor:G-CSF),インターロイキン(IL-1,IL-6など),腫瘍壊死因子(tumor necrosis factor:TNF)などのサイトカインを産生する.とりわけ癌悪疫質(cachexia)やG-CSFによる白血球増加症は,高カルシウム血症としばしば共存する症候である.また,IL-6の働きによる低アルブミン血症も担癌患者でよくみられ,後に述べるように,血清カルシウム値の正確な評価に大きな影響を与えるので注意を要する.
検査成績
HHMの血液・尿生化学検査では,高カルシウム血症・低リン血症・TmP/GFRの低下・高PTHrP血症・血中PTHの低値・尿中cAMP排泄の増加・尿中カルシウム排泄量の増加・血清1,25-(OH)2-Dの低値が特徴的である.担癌患者では,低アルブミン血症を伴うことが多いので,血清アルブミン値が4.0 g/dL以下のときは,補正Ca=測定Ca+(4−血清アルブミン)の式に従って補正Ca値を計算して評価する必要がある.高カルシウム血症が明らかになる前に,高カルシウム尿症(1日の排泄量が200 mg以上)で早期診断される場合もある.
正常の骨代謝においては,破骨細胞による骨吸収に引き続いて骨芽細胞による骨形成が開始される(骨の“カップリング(coupling)”).悪性腫瘍に伴う高カルシウム血症の病態では,骨吸収が著明に亢進するにもかかわらず骨形成は抑制され,正常な“カップリング”機能が破綻し“uncoupling”の状態にある.骨吸収の生化学的指標となる血清CTX濃度(CTXは骨基質であるコラーゲンの分解産物)が上昇し,骨芽細胞機能を反映する血清オステオカルシン濃度が低下する.
診断
悪性腫瘍患者で,高カルシウム血症・低リン血症・高PTHrP血症・血中PTHの低値があればHHMの診断は確実である.健常者の血漿PTHrP(1-87)レベルは1.1 pmol/L以下で,1.5以上でHHMの疑いが濃く,2.0 pmol/L以上で診断は確実である.
鑑別診断
PTH過剰による原発性副甲状腺機能亢進症,および活性型ホルモンである1,25-(OH)2-Dの過剰症による高カルシウム血症と鑑別を要する(表12-5-13).前者では血中PTHレベルが上昇し,後者では1,25-(OH)2-D3製剤やプロドラッグの1α-(OH)-D3を投与されているか,サルコイドーシスや結核症などの肉芽腫症が存在する.HHMとLOHの鑑別は,基礎疾患と前者で血中PTHrPの高値・低リン血症がみられることである.
合併症
担癌患者では,PTHrPのほかにさまざまなホルモン・サイトカインが過剰産生され,多様な腫瘍随伴症候群が存在する可能性があることを念頭に置く必要がある.なかでも癌悪疫質(cachexia)や白血球増加症は,高カルシウム血症とよく合併してみられる.
経過・予後
一般に,高カルシウム血症は進行期の悪性腫瘍患者にみられ,それ自体予後不良のサインである.しかしながら,腫瘍が限局し手術によって摘除可能な場合にはHHMは完治する.血液系の悪性腫瘍の場合にも,化学療法で寛解が得られている間は,高カルシウム血症も是正される.
治療
高カルシウム血症を起こす悪性腫瘍に対する治療が根治的である.同時に,悪性腫瘍に伴う高カルシウム血症は急速に進行し,腎不全や意識障害をもたらす場合もあるので,高カルシウム血症に対する対症療法も癌患者のQOLを改善する上で重要である.
HHMにおいてもLOHにおいても,高カルシウム血症は,①骨吸収の亢進と②腎におけるカルシウム再吸収の亢進によることから,①カルシトニンやビスホスホネートなどの骨吸収抑制薬の投与と,②生理食塩水の大量補液とループ利尿薬によって,脱水の改善とナトリウムの排泄と共役する形でカルシウムの排泄促進をはかる.カルシトニンは,骨吸収を担う破骨細胞に直接働いて骨吸収活性を抑制するため即効性であるが,連用によって効果が失われる(エスケープ現象).ビスホスホネートは,ピロリン酸のP-O-Pを,アルカリホスファターゼ(alkaline phosphatase)による分解を防ぐためにP-C-Pに変えた一群の薬物で,骨に選択的に移行し破骨細胞による骨吸収を強力に抑制する.[池田恭治]
■文献
Broadus AE, Mangin M, et al: Humoral hypercalcemia of cancer: identification of a novel parathyroid hormone-like peptide. N Engl J Med, 319: 556-563, 1988.
Stewart AF: Hypercalcemia associated with cancer. N Engl J Med, 352: 373-379, 2005.
Strewler GJ: The physiology of parathyroid hormone-related protein. N Engl J Med, 342: 177-185, 2000.
出典 内科学 第10版内科学 第10版について 情報