内科学 第10版 の解説
不整脈の発生順序と電気生理学的検査(不整脈)
心臓の中を,細胞興奮(活動電位)が,洞房結節から左右の心房,房室結節,His束,左右脚,Purkinje線維網,そして左右の心室へと,一定の道筋(刺激伝導系)に沿って順序よく伝わり,消失すれば不整脈は発生しない.この途中で「興奮の伝わりにくい場所」や「異常な興奮を発生する場所」があると,さまざまな不整脈が発生する.このような場所を「基質」とよぶ.不整脈の成因には,基質ができるまでの過程(上流)と,基質ができたあとの過程(下流)がある.
a.発生機序の下流
ⅰ)自動能異常
洞房結節,His-Purkinje系組織など,本来ペースメーカ機能をもっている組織に異常が生ずると,洞性頻脈,洞性徐脈,洞停止,心室固有調律亢進などが起こる.交感神経緊張によるβ1受容体刺激は,過分極活性化内向き電流(If),L型Ca2+チャネル電流(ICa,L)などの増大を介して洞房結節自動能亢進をもたらす.副交感(迷走)神経緊張によるムスカリン(M2)受容体刺激は,Ifの減少とアセチルコリン感受性K+チャネル電流(IK,ACh)の増大を介して洞房結節の自動能低下をもたらす.
心房,心室の心筋細胞は,通常は自発興奮を示さないが,さまざまな病態下で静止電位が減少した場合は,自動能をもつようになる(異常自動能).心筋梗塞急性期の心室固有調律亢進は,梗塞巣付近の傷害心筋から発生する異常自動能が原因とされる.最近では,発作性心房細動の原因の1つとして,肺静脈が左心房に開口する部分から発生する自発興奮が注目されている.
ⅱ)撃発活動(triggered activity)
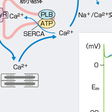
撃発活動は活動電位に引き続き発生する後電位が増大し,それが閾値に達すると,単発または反復性の興奮が発生する現象である.後電位には,早期後脱分極(early afterdepolarization:EAD)と遅延後脱分極(delayed afterdepolarization:DAD)の2種類がある(図5-6-1).EADは,先行する活動電位の再分極の途中(第2相または3相)から生ずる膜電位振動であり,活動電位持続時間(APD)の過度の延長に続いて発生することが多い.徐脈や低カリウム血症はEADの発生を助長する.EADによって起こる代表的な不整脈は,QT延長症候群に伴う多形性心室頻拍(torsade de pointes:TdP)である.DADは,先行する活動電位の再分極が終了した後の第4相で起こる膜電位振動であり,ジギタリスやカテコールアミン作用下,あるいは虚血・再灌流などのように細胞内Ca2+過負荷をきたす状況で発生する.このような状況では,細胞内Ca2+貯蔵庫である筋小胞体(SR)から周期的なCa2+放出が起こり,それに呼応してNa+/Ca2+交換機構(NCX)やCa2+感受性陽イオンチャネル(INSC)を介する内向き電流が発生する(図5-6-1).
ⅲ)リエントリー(reentry)
興奮波が1心周期の間に消失せずに,再びもとの部位に戻ってきて,心臓を再興奮させることがあり,興奮の再侵入(リエントリー)とよばれる.頻脈性不整脈の機序としては,最も頻度が高い.リエントリーの成立を促す条件としては,一方向ブロック,遅い伝導,不応期の短縮,リエントリー経路の存在などがある.
1)解剖学的リエントリー:
興奮旋回が特定の構造を基盤とするものであり,リエントリー経路が固定されている(ordered reentry).この代表はWPW症候群にみられる発作性上室頻拍(房室回帰性頻拍)であり,心房→房室結節→心室→副伝導路→心房の経路か,あるいはその逆の経路をたどる(図5-6-13参照).解剖学的リエントリーでは,頻拍の心拍数は旋回経路の長さと興奮伝導速度で決まるため,ほぼ一定であることが多い.
2)機能的リエントリー:
機能的リエントリーは,特定の解剖学的構造を必要とせず,条件がそろえば心臓のどの部分でも発生し,1拍ごとに旋回経路が変化する(random reentry).局所の心筋伝導性の低下や,不応期の不均一性増大は,心房や心室内での機能的リエントリー発生を促し,頻拍や細動の原因となる.機能的リエントリーの成立機構としては,以下のメカニズムが提唱されている. a)リーディングサークル(leading circle):組織の一部に,周囲より不応期が長い部分があると,期外刺激を加えたときに,その領域に一方向ブロックが生じ,興奮の旋回が始まる.中心部では静止電位が減少して興奮性が失われ,不活性中心が形成される(図5-6-2A).リーディングサークル型のリエントリーでは経路の中で不応期を脱した部分(興奮間隙)がほとんど存在しない. b)異方性リエントリー(anisotropic reentry):個々の心筋細胞はギャップ結合(gap junction)を介して隣接する細胞と電気的に結合し,それらは束になって筋束を形成している.gap junctionは,細胞長軸端の介在版部分に集中しており,細胞側面にはまばらである.加齢が進むと,筋束と筋束の間の結合組織が増えて,短軸方向の連絡はさらに悪くなる.心筋梗塞後の残存心筋や,心筋炎,心筋症に伴う細胞配列の乱れ,線維組織の増加などがあると,さらに複雑な異方性(anisotropy)が発生する.このようなミクロの細胞構築が伝導特性の空間的不均一性をもたらし,リエントリー発生の諸条件が成立する(図5-6-2B). c) スパイラルリエントリー(spiral reentry):コンピュータシミュレーションから提唱された概念であり,活動電位の光学マッピング実験でその実態が解析できるようになった.心臓の中を進む興奮波が,先行興奮の不応期がまだ残っている部分や,梗塞巣,瘢痕などの障害物にぶつかると,興奮波の端が途切れて,興奮前面に湾曲ができる.この湾曲は,端に向かうにつれて大きくなる.興奮波の端では,興奮前面が再分極終末とぶつかって,伝導速度が0となる特異点が形成される.そして,興奮は,この点を中心として螺旋(スパイラル)を描いて旋回し続けることになる(図5-6-2C).スパイラルの中心は不安定なことが多く,容易にさまよい運動を起こす.スパイラルが多数に分裂して全体の統制が失われたようにみえることもある.
b.発生機序の上流
ⅰ)イオンチャネルの遺伝子異常
1)QT延長症候群: イオンチャネル遺伝子異常により致命的な不整脈を起こす代表的な疾患は先天性QT延長症候群であり,常染色体優性遺伝を示すRomano-Ward症候群と,劣性遺伝を示すJervell-Lange-Nielsen症候群に分けられる.後者は前者に比べて発生頻度が低く,聴力障害を伴う.両者とも心電図ではQT間隔が延長し,TdPタイプの心室頻拍や心室細動による失神発作あるいは突然死を起こす危険性がある. 原因遺伝子としてはK+チャネルサブユニットであるKCNQ1,KCNH2,KCNE1などが,またNa+チャネルサブユニットであるSCN5AやCa2+チャネルサブユニットであるCACNA1Cが同定されており,それらは染色体上の遺伝子座から10型以上(2012年現在で13型)に分類されている.K+チャネルの遺伝子異常では,活動電位の再分極を促す外向き電流が減少する(機能喪失).一方Na+チャネルとCa2+チャネルの遺伝子異常では,活動電位発生中に内向き電流が十分不活性化されない(機能獲得).いずれもAPDが過度に延長しEADからTdPが発生しやすくなる.
2)特発性心室細動: 特発性心室細動とは,明らかな基礎疾患を認めず,一見健康と思われる人に突然出現する心室細動である.このうちBrugada症候群とよばれる一群の病態は若年~中年男性に多く,20〜30%に突然死の家族歴がある.非発作時の心電図では,右脚ブロックと右側胸部誘導のST上昇が認められる.心室細動発作は,夜間就眠中や食後の安静時に多い(副交感神経活動優位の状態).Na+チャネル抑制薬(I群抗不整脈薬)は,本症候群の心電図変化を増強し,心室細動発作を促す傾向がある.原因としてはNa+チャネル遺伝子(SCN5A)の異常(機能喪失)が15〜25%に認められるが,それだけでは説明できない部分もある.
このほか,家族性の重症心室不整脈のなかには,筋小胞体のCa2+ハンドリングを制御するCa2+放出チャネル(RyR2)やカルセクエストリン(CASQ2)の遺伝子異常を示す家系があり,カテコールアミン感受性多形性心室頻拍(catecholaminergic polymorphic ventricular tachycardia:CPVT)とよばれる.
ⅱ)心筋の電気的リモデリング
1)心肥大・心不全: 弁膜症や高血圧などによって心臓に圧負荷や容量負荷が加わると,心臓は適応現象として肥大を起こすが,やがて代償機構が破綻して心不全となる.心肥大・心不全に伴う特徴的な活動電位変化はAPDの延長である.この変化は心室各部で不均一に生ずるため,不応期の不均一性が増大し,リエントリー発生の素地をつくる.過度のAPD延長からEADや撃発活動(triggered activity)を起こすこともある.このAPD延長は,一過性外向き電流(Ito)や遅延整流K+チャネル電流(IKr,IKs)の減少によるものであり,それらのチャネルをコードする遺伝子の発現低下が報告されている.Na+/Ca2+交換機構の増強やNa+/K+ポンプの機能低下が異常興奮発生に寄与する可能性や,成熟した生体の心室筋には通常存在しないIfやT型Ca2+チャネル電流(ICa,T)が発現することも報告されている.さらに,心不全に陥った心筋では,筋小胞体Ca2+放出チャネル(リアノジン受容体RyR)の機能異常が生じており,撃発活動による異常興奮を発生させる(図5-6-1).2)心房細動: 心房細動は,多くの場合,発作性心房細動として発症し,次第にその頻度と持続時間が増して,次第に慢性化する.このような病態の進展には,心房筋のリモデリングが寄与している.心房細動や心房高頻度刺激の持続は,心房筋のAPD短縮と不応期短縮をもたらし,リエントリーの成立を促す.APD短縮にはL型Ca2+チャネルの遺伝子発現低下が主要な役割を果たすと考えられている.Na+チャネル電流(INa)の減少,gap junction蛋白の発現低下なども報告されている.長期的には,電気的なリモデリングに形態学的なリモデリング(心房筋配列の変化や間質の線維化)が加わって,心房細動の慢性化が進行する.
(2)電気生理学的検査
電気生理学的検査は,不整脈の診断,発生部位や機序の解明,重症度評価および抗不整脈薬の薬効評価に用いられる.最近はペースメーカの機種選定や植え込み型除細動器の適応および,カテーテルアブレーションなど非薬物治療の術前検査として用いられることが多い.
a.目的
ⅰ)原因精査
不整脈に起因すると思われる動悸,めまい,失神などの症状がある場合は,Holter心電図やベッドサイドモニターなどを施行する.しかし,これらによって症状に一致する不整脈が記録される確率は必ずしも高くない.そこで,電気生理学的検査によって発作の原因となる不整脈を誘発し,症状とともに心電図や血圧の変化などと比較する.
ⅱ)診断
徐脈性不整脈のうち洞機能不全症候群の確定診断や房室ブロックにおける伝導障害部位の診断にはHis束心電図を記録する.頻脈性不整脈では発作性上室性頻拍,心房頻拍,心房粗動および心室頻拍などの確定診断をつけるために発作中の心内心電図の記録を行う.これらの不整脈は体表面心電図からは鑑別が困難な場合が少なくない.
ⅲ)治療方針決定
それぞれの不整脈の最適な治療法は,それらの電気生理学的性質を調べて決定するのが望ましい.無投薬下で誘発された頻拍が,薬剤投与後に同一の方法で頻拍が誘発不能となった場合には有効と判定される.また慢性投与による頻拍発作の予防効果を予測しうる指標となる.さらに抗不整脈薬の催不整脈作用の評価にも有用である.また副伝導路症候群では副伝導路の伝導能や不応期によってハイリスク群が同定される.さらに,房室結節二重伝導路の同定,副伝導路付着部位,および心室頻拍の発生部位の同定はカテーテルアブレーションや外科手術の術前検査として不可欠である.一方,徐脈性不整脈に対するペースメーカ植え込みにあたっても至適機種の決定には電気生理学的検査が必要なことがある.最近では,植え込み型除細動器による除細動治療の適否を決定するうえで電気生理学的検査を行うこともある.
b.方法
大腿静脈より電極カテーテルを挿入し,高位右房,His束,右室心尖部(場合により右室流出路)に留置する.さらに発作性上室性頻拍の症例などでは鎖骨下静脈より冠静脈洞にも電極カテーテルを挿入する.左室起源の心室頻拍や左室に付着する副伝導路が疑われた場合は,さらに大腿動脈より電極カテーテルを挿入し,左室に留置する(図5-6-3).最近は,一度に多くの電位情報を心腔内各所から得ることができる特殊な電極カテーテルも使用される.磁場を利用して心内の電位をさまざまな測定点で記録することにより,心臓の立体画像を構成し電位の大きさや興奮伝播過程を視覚化できるシステムも開発されている(図5-6-4).
c.プログラム刺激
電気刺激は高頻度刺激(自己調律より早い刺激頻度でペーシングする)と早期刺激法(自己調律またはそれより早い刺激頻度でペーシングした後に早期刺激を加える.早期刺激数により,単一刺激,二連続刺激および三連続刺激がある)に分けられる.これらのプログラム刺激により自動能と伝導能の評価および発作性頻拍の分析と治療法の評価が可能となる.
ⅰ)自動能評価
洞房結節を自己調律以上の頻度で刺激すると,その自動能が抑制され(overdrive suppression test),洞房結節自動能の評価法として用いられる.刺激停止直後最初に出現するP波までの時間を洞結節自動能回復時間(sinus node recovery time:SNRT)とよぶ.SNRT≧1600 msecの場合か,洞調律時のPP間隔と比較し,160%以上の延長を認めれば (%SNRT≧160%),洞機能不全と診断する.
ⅱ)伝導能評価
1)高頻度刺激法:
心房刺激頻度を増加させるとAH時間は延長し,ついで数拍ごとにブロックが起こるWenckebach周期となり,さらに2:1ブロックとなる.Wenckebach周期が出現するペーシングレートが130/分以下の場合は房室結節の伝導障害が疑われる.また副伝導路部位診断やその伝導能が評価され,心室ペーシングにより房室結節や副伝導路の逆行伝導が評価される.
2)早期刺激法:
心房,房室結節,His-Purkinje系,副伝導路の順行伝導および逆行伝導の不応期が測定できる.
3)発作性頻拍の評価:
プログラム刺激法によって,発作性上室頻拍や心室頻拍が誘発あるいは停止される.これにより発作性頻拍の種類,頻拍の機序,カテーテルアブレーション,手術療法および植え込み型除細動器の適応が決定される(図5-6-5).[児玉逸雄・渡邉英一]
■文献
Antzelevitch C: Mechanisms of cardiac arrhythmias and conduction disturbance. In: Hurst’s The Heart (12th ed) (Fuster V, O’Rourke RA, et al eds), pp.913-945, McGraw-Hill, New York, 2008.
出典 内科学 第10版内科学 第10版について 情報