ヒ素
ひそ
arsenic
周期表第15族に属し、窒素族元素の一つ。ヒ素の化合物は洋の東西を問わず古くから知られ、天然に産出する鶏冠(けいかん)石や雄黄(ゆうおう)(石黄(せきおう))については紀元前400年ころまでに、その薬理作用などがアリストテレスによって記載されているが、ヒ素が単体として遊離されたのは13世紀の神学者アルベルトゥス・マグヌスによる。錬金術の盛んな16世紀にはヒ素がいろいろな金属と結合し、銅に塗ると銀のようにみえることなどから、金属変換の重要な要素と考えられた。名称はギリシア語の雄黄arsenikonに由来する。日本語では江戸時代の蘭学者である宇田川榕庵(ようあん)の『舎密開宗(せいみかいそう)』に「亜爾攝尼究母(アルセニキユム)、砒(ひ)」と記されている。砒は砒石、砒霜(酸化ヒ素)からきたものである。明治以降は砒素が用いられている。
[守永健一・中原勝儼]
天然に遊離して産出することもあるが、雄黄(石黄)As2S3、鶏冠石As4S4、硫砒(りゅうひ)鉄鉱FeAsSなど、おもに硫化鉱物として存在する。そのほかにヒ華、単斜ヒ華などの酸化物やヒ化物などの鉱物が知られる。銅または鉛の製錬に際し副産物として得られる。硫化鉱を焙焼(ばいしょう)して三酸化二ヒ素As2O3とし、加熱昇華させて精製したのち、木炭で還元すると金属を得る。純度の高いものは、いったん塩化ヒ素とし、これを蒸留して精製してから、水素で還元してつくったヒ素を温度勾配(こうばい)をつけて電気炉中で昇華精製する。純度99.99999%以上のものが得られる。
[守永健一・中原勝儼]
灰色ヒ素、黄色ヒ素(立方晶系、比重1.97)および黒色ヒ素(無定形、比重4.73)の3変態が知られる。四面体形四原子分子As4を含む黄色ヒ素はヒ素の蒸気を急冷してつくられる。しかし、すぐに金属光沢をもつ普通のヒ素すなわち灰色ヒ素または金属ヒ素とよばれる安定形に変わる。黄色ヒ素の構造は白リンと同じで、金属ヒ素は黒リンに似た構造をもち、いくらか導電性がある。空気中で熱すると三酸化二ヒ素を生じ、ハロゲンとも容易に反応する。濃硫酸・硝酸に溶けて亜ヒ酸、濃硝酸に溶けてヒ酸となる。酸素があると塩酸にも溶けて塩化ヒ素(Ⅲ)をつくる。アルシン(ヒ化水素)AsH3を熱分解すると黒色ヒ素を生じる。
[守永健一・中原勝儼]
合金添加剤に用いられる。銅に少量加えると耐熱性を増し、鉛に加えると硬さを増すなどの特徴をもち、主として鉛‐アンチモン系の軸受合金などに添加される。最近は高純度ヒ素の用途が開けつつある。ヒ化ガリウムGaAs、ヒ化インジウムInAsなどの化合物半導体として、また半導体への添加剤として用いる。とくにGaAsは赤色あるいは赤外発光ダイオード、マイクロ波素子、集積回路、半導体レーザー、太陽電池などに用いられる。ヒ素の硫化物、高純度ヒ素の単結晶は赤外線をよく通すので赤外線写真用レンズ、フィルターなどに用いられる。
[守永健一・中原勝儼]
単体ヒ素には毒性がない(あるいは弱い)と考えられているが、ヒ素の化合物は有毒で農薬用に使われるが、生物への蓄積を恐れて他のものに置き換えられつつある。三酸化二ヒ素はガラスの透明度をあげたり脱色したりする目的で少量添加される。ヒ素化合物には強い毒性をもつものが多い。
[守永健一・中原勝儼]
出典 小学館 日本大百科全書(ニッポニカ)日本大百科全書(ニッポニカ)について 情報 | 凡例
ヒ素
ヒソ
arsenic
As.原子番号33の元素.電子配置[Ar]3d104s24p3の周期表15族非金属元素.原子量74.92160(2).安定核種が質量数75の同位体のみの単核種元素.ほかに60~92の放射性同位体がある.紀元前から硫化物などとして知られており,単体は13世紀の錬金術師Albertus Magnusがヒ素鉱物中に金属が含まれていることを認めていたが,1649年にJ. Schröderが酸化物を木炭で還元して,単体の分離にはじめて成功した.硫化物鉱物石黄の黄金色を表すアラビア語al-zarnikhがギリシアに入ってαρσενικον(arsenikon)となり,さらにラテン語名arsenicumにかわって,現在の英語の元素名arsenicとなった.宇田川榕菴は天保8年(1837年)に出版した「舎密開宗」で,亜爾攝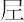 究母(アルセニキュム)砒としている.
究母(アルセニキュム)砒としている.
天然には,単体はまれに産出されるが,鶏冠石AsS,石黄As2S3,硫ヒ鉄鉱FeAsSなどが代表的な鉱物で,自然界に広く分布している.地殻中の存在度1.0 ppm.いん石(コンドライト)中にも ppm けたで存在する.非鉄金属製造で硫化鉱を処理するときに生じる煙灰中から回収し,加熱昇華で分離し,炭素で還元する.3種の同素体がある.室温で安定な灰色の金属ヒ素(α相)は三方晶系で,黒リンと同様の層状構造をしている.密度5.78 g cm-3(20 ℃).第一イオン化エネルギー946.5 kJ mol-1(9.81 eV).六配位の AsⅢおよび AsⅤのイオン半径はそれぞれ0.058,0.046 nm.加熱すると616 ℃ で昇華する.蒸気組成は四面体型 As4 で,急冷すると蒸気は凝縮して,密度4.70 g cm-3(20 ℃),六方晶系の黄色ヒ素になるが,不安定で,光や放置,加熱で灰色の金属性ヒ素にかわる.転移の中間形が無定形の黒色ヒ素(β相)で,密度は4.6~5.2 g cm-3.ヒ素は酸化数3,5で化合物をつくる.水,希酸,アルカリ溶液には不溶,硝酸,濃硫酸にはH3AsⅢ O3やH3AsⅤ O4となって溶ける.乾燥した空気中で安定であるが,加熱すると燃えてAs2O3になる.空気を断って,硫黄Sやハロゲン X2 と加熱すると,それぞれAs2S3,AsX3(F2 ではAsF5)が生成する.多くの金属とは高温で直接反応し,ヒ化物を生じる.多くの有機ヒ素化合物があるが,重要なものにアルシン酸R2AsⅤO(OH),アルソン酸RAsⅤO(OH)2(R:アルキル基,アリル基,ヘテロ環状基)とそれらの塩がある.
メチルアルシン酸,ジメチルアルシン酸,フェニルアルソン酸,ジフェニルアルシン酸は農薬(除草剤),医薬品に使用される.ジフェニルシアノアルシン,ジフェニルクロロアルシンはおう吐剤(旧日本軍化学兵器).超高純度ヒ素は化合物半導体として需要最大のヒ化ガリウムGaAs製造に用いられる.亜ヒ酸塩,ヒ酸塩は殺虫剤(農薬),防腐剤,なめし剤,なせんなどに使用される.そのほか,殺鼠剤,防蟻(ぎ)剤,除草剤,塗料,ガラス消泡剤に使用される.液晶ディスプレイガラス用がわが国の需要の大半を占めていたが,環境への配慮から無ヒ素化が進んでいる.合金への添加剤として,銅,鉛に添加すると硬さや耐食性が向上するので鉛蓄電池極板に使用される.毒性が強く,ヒ素,ヒ素化合物およびこれを含有する製剤は毒物劇物取締法の毒物に指定されている.PRTR法・特定第一種物質・発がん性クラス1,経口クラス2,作業環境クラス1.急性毒性の強さはアルシンAsH3がもっとも強く,亜ヒ酸塩がこれにつぐ.ヒ素化合物の致死量は1.5 mg/kg 体重(酸化ヒ素).急性中毒症状は,腹痛,おう吐,下痢,筋肉痛など.亜ヒ酸塩は労働安全衛生法の特定化学物質.「ヒ素及びヒ素化合物」は水道法水質基準値ヒ素の量に関して0.01 mg/L 以下,水質汚濁防止法有害物質で排水基準値ヒ素の量に関して0.1 mg/L 以下,土壌汚染対策法特定有害物質で,基準値は同じくヒ素の量に関して土壌含有量150 mg/kg 以下である.[CAS 7440-38-2]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ヒ素
ヒそ
arsenic
元素記号 As ,原子番号 33,原子量 74.92160。周期表 15族,窒素族元素の1つ。天然には硫ヒ鉄鉱,鶏冠石などとして産出するが,ときには遊離の状態で産出することもある。地殻における存在量 1.5ppm,海水中の平均濃度2 μg/l 。工業的には銅製錬工場の排煙中の固体を集塵して粗ヒをつくり,精製して得ることが多い。単体には灰色,黒色,黄色の3種の同素体があり,灰色ヒ素が普通のものである。これは金属ヒ素ともいわれ,菱面体結晶である。融点 817℃,昇華点 613℃,比重 5.73。黄色ヒ素は灰色ヒ素の蒸気の急冷によって得られるろう状,透明な小結晶。比重 1.97。非導電性。ヒ素の化学的性質はリンに類似している。化合物は一般にきわめて有毒である。
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
ヒ素
原子番号33,原子量74.92159,元素記号As,15族(旧Va族)の元素.毒性の強い元素であるが,微量必須元素でもある.日本も米国も摂取基準を示していないが,成人で1日12〜25μgであろうとの推定がある.
出典 朝倉書店栄養・生化学辞典について 情報


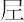 究母(アルセニキュム)砒としている.
究母(アルセニキュム)砒としている.